
|
КОНСПЕКТИ ЛЕКЦІЙ, ШПАРГАЛКИ
Неорганічна хімія. Шпаргалка: коротко, найголовніше
Довідник / Конспекти лекцій, шпаргалки Зміст
1. Взаємозв'язок між процесами обміну речовин та енергії в організмі. Термодинамічна система Процеси життєдіяльності на Землі обумовлені значною мірою накопиченням сонячної енергії в біогенних речовинах (білках, жирах, вуглеводах) та подальшими перетвореннями цих речовин у живих організмах із виділенням енергії. Роботи А. М. Лавуазьє (1743-1794) та П. С. Лапласа (1749-1827) прямими калориметричними вимірами показали, що енергія, що виділяється в процесі життєдіяльності, визначається окисленням продуктів харчування киснем повітря, що вдихається тваринами. З розвитком у XIX-XX ст. термодинаміки стало можливо кількісно розраховувати перетворення енергії в біохімічних реакціях та передбачати їх напрямок. Термодинамічний метод заснований на низці суворих понять: "система", "стан системи", "внутрішня енергія системи", "функція стану системи". Термодинамічною системою називається всякий об'єкт природи, що складається з досить великої кількості молекул (структурних одиниць) і відокремлений від інших об'єктів природи реальною або уявною граничною поверхнею (кордоном розділу). Об'єкти природи, які входять у систему, називаються середовищем. Найбільш загальними характеристиками систем є т – маса речовини, що міститься в системі, та Е – внутрішня енергія системи. Маса речовини системи визначається сукупністю мас молекул, у тому числі вона складається. Внутрішня енергія системи є сумою енергій теплового руху молекул та енергії взаємодії між ними. Системи за характером обміну речовиною та енергією з навколишнім середовищем поділяють на три типи: ізольовані, закриті та відкриті. Ізольованою системою називається така система, яка не обмінюється із середовищем ні речовиною, ні енергією (Δm = 0, ΔE = 0). Закритою системою називається така система, яка не обмінюється із середовищем речовиною, але може обмінюватися енергією (Δm = 0, ΔE^0). Обмін енергії може здійснюватись передачею теплоти або виконанням роботи. Відкритою системою називається така система, яка може обмінюватися з середовищем як речовиною, так і енергією (Δm ≠ 0, ΔE ≠ 0). Важливим прикладом відкритої системи є жива клітка. Системи залежно від агрегатного стану речовини, з якої вони складаються, поділяють на гомогенні та гетерогенні. У гомогенній системі відсутні різкі зміни фізичних та хімічних властивостей під час переходу від одних областей системи до інших. Прикладом такої системи може бути плазма крові, що є розчином різних біогенних речовин. Гетерогенна система і двох чи більше гомогенних частин. Прикладом гетерогенної системи є цільна кров, тобто плазма з клітинами – еритроцитами та лейкоцитами. 2. Перший початок термодинаміки. Поняття, що характеризують систему Перший початок термодинаміки є суворою кількісною основою для аналізу енергетики різних систем. Для його формулювання необхідно запровадити низку нових понять, що характеризують систему. Одним із найважливіших понять є стан системи. Під станом розуміють сукупність властивостей системи, дозволяють визначити систему з погляду термодинаміки. Як узагальнену характеристику стану системи застосовують поняття: "рівноважний", "стаціонарний", "перехідний стан". Стан системи називається рівноважним, якщо всі властивості залишаються постійними протягом будь-якого великого проміжку часу і в системі відсутні потоки речовини та енергії. Якщо властивості системи постійні у часі, але є потоки речовини та енергії, стан називається стаціонарним. Кількісно стану розрізняють за допомогою термодинамічних змінних. Термодинамічні змінні - такі величини, що характеризують стан системи загалом. Їх називають ще термодинамічні параметри системи. Найважливішими термодинамічних змінних є тиск р, температура Т, об'єм системи V або загальна маса системи m, маси хімічних речовин (компонент) mk, з яких складається система, або концентрація цих речовин ті. Слід зазначити, що аналогічні характеристики (температура, маса, склад біологічних рідин, артеріальний тиск) використовуються лікарем визначення стану хворого. Перехід системи з одного стану до іншого називається процесом. В результаті процесу стан системи та термодинамічні змінні змінюються. Якщо позначити значення термодинамічної змінної у початковому стані через Х1 , в кінцевому - X2 , то зміна цієї змінної відповідно дорівнює ΔX = X2 - Х1 і називається збільшенням термодинамічної змінної X. Прирощення, взяте зі зворотним знаком, називається зменшенням змінної X. Внутрішня енергія системи Е – одна з термодинамічних функцій стану. Важлива особливість функцій стану – їхня незалежність від способу досягнення даного стану системи. Зміна внутрішньої енергії системи ΔE обумовлено роботою W, яка відбувається при взаємодії системи з середовищем, та обмін теплотою Q між середовищем та системою, відношення між цими величинами становить зміст першого початку термодинаміки. Приріст внутрішньої енергії системи ΔE в деякому процесі дорівнює теплоті Q, отриманої системою, плюс робота W, досконала над системою в цьому процесі: ΔE = Q + W. У біологічних системах теплота зазвичай віддається системою у зовнішнє середовище, а робота здійснюється системою за рахунок зменшення внутрішньої енергії. Математичну запис першого початку термодинаміки зручно подати у вигляді: ΔE = Q - W. Усі величини наведених формулах вимірюються в джоулях (Дж). 3. Перший початок термодинаміки Перше початок термодинаміки належить до фундаментальних законів природи, які можуть бути виведені з інших законів. Його справедливість доводять численні експерименти, зокрема невдалі спроби побудувати вічний двигун першого роду, т. е. таку машину, яка б як завгодно довго виконувати роботу без підведення енергії ззовні. Залежно та умовами протікання процесу у системі використовують різні функції стану, які виводять із першого початку термодинаміки. При цьому замість складних біологічних систем для отримання висновків про перетворення маси та енергії використовують спрощені моделі. Тиск у системі при цьому підтримується постійним, він дорівнює зовнішньому тиску. Такі процеси, що протікають при р = const, називаються ізобарними. Робота розширення, що здійснюється при ізобарному процесі, як відомо, дорівнює: W = ρΔV, де ΔV - збільшення обсягу системи, рівне різниці обсягів у станах 2 і 1. Підставляючи роботу розширення в математичне вираження першого початку та провівши нескладні перетворення, отримуємо: Qρ = ΔE + pΔV = (E2 + ρV2) - (E1 + ρΔV1) де Qρ – теплота ізобарного процесу; 1, 2 - індекси, що відносяться до початку та кінця процесу. Величина (E+ pV) - функція стану системи, що позначається через Н і називається ентальпією: H = E + ρV. Відповідно, вираз можна записати у вигляді: Qp = Н2 - Н1 = ΔH. З цього виразу випливає, що ентальпія - функція стану, збільшення якої дорівнює теплоті, отриманої системою в ізобарному процесі. Вимірювання збільшення ентальпії в деякому процесі може бути здійснено при проведенні цього процесу в калориметрі при постійному тиску. Саме так проводили свої експерименти А. М. Лавуазьє та П. С. Лаплас, вивчаючи енергетику метаболізму в живому організмі. У тих випадках, коли зміна стану системи відбувається за постійного об'єму, процес називається ізохорним. Зміна об'єму AV при цьому дорівнює нулю, і відповідно до формули робота розширення W = 0. Тоді з математичного вираження першого початку термодинаміки випливає: Qv = ΔE. З вищезгаданого співвідношення випливає термодинамічний визначення: внутрішня енергія - функція стану, збільшення якої дорівнює теплоті QV, отриманої системою в ізохорному процесі. Отже, зміна внутрішньої енергії в деякому процесі може бути виміряна під час проведення цього процесу в калориметрі при постійному обсязі. Слід, що при ρ = const збільшення внутрішньої енергії та ентальпії пов'язані співвідношенням: ΔH = ΔE + ρΔV. 4. Закон Геса Розділ термодинаміки, що вивчає перетворення енергії при хімічних реакціях, називається хімічною термодинамікою. Рівняння реакції, на яку вказуються відповідні цієї реакції зміни внутрішньої енергії ΔE, ентальпії ΔH або будь-якої іншої функції стану, називається термохімічним. Хімічні реакції, при протіканні яких відбувається зменшення ентальпії системи (ΔH < 0) та у зовнішнє середовище виділяється теплота, називаються екзотермічними. Реакції, внаслідок яких ентальпія зростає (ΔH > 0) та система поглинає теплоту Qp ззовні, називаються ендотермічними. Окислення глюкози киснем відбувається із виділенням великої кількості теплоти (Qp = 2800 кДж//моль), тобто цей процес – екзотермічний. Відповідне термохімічне рівняння запишеться у вигляді С6 Н12 О6 + 602 = 6С02 + 6Н2О, H = 2800 кДж. Реакції, які у розчині, супроводжуються зазвичай незначним зміною обсягу системи, т. е. ΔV ≈ 0. У зв'язку з цим у часто при біологічних розрахунках вважатимуться, що ΔH = ΔE. Отже, виділення теплоти в таких системах обумовлено переважно зменшенням внутрішньої енергії в результаті протікання реакції, і навпаки. Ентальпією утворення сполуки А називається зміна ентальпії системи HA , що супроводжує утворення 1 молячи сполуки А з простих речовин. Ентальпії утворення кисню, вуглецю, водню та інших елементних (простих) речовин приймають рівними нулю. За інших рівних умов внутрішня енергія та ентальпія пропорційні кількості речовини в системі. Такі термодинамічні функції називають екстенсивними. З погляду термодинаміки реакція загального виду nAА+пВ = пС + нD , Δh являє собою перехід системи з початкового стану з ентальпією Н1 у стан 2 з ентальпією Н2. Зміна ентальпії системи в результаті цього переходу, зване ентальпією даної реакції, дорівнює різниці: ΔHpя = Н2 - Н1 = (ніcHc + нDHD) - (nАНА + нBHB). Закон сталості теплових сум, відкритий російським вченим хіміком Г. І. Гессом в 1840 р. Він є першовідкривачем застосування першого початку термодинаміки при хімічних перетвореннях та засновником хімічної термодинаміки. В даний час закон Гесса розглядається як наслідок першого початку термодинаміки і формулюється так: приріст ентальпії при утворенні заданих продуктів з даних реагентів при постійному тиску не залежить від числа та виду реакцій, в результаті яких утворюються ці продукти. При термохімічних розрахунках частіше застосовується сам закон Гесса, яке наслідок, виведене вище для окремого випадку окислення глюкози як рівності (2). Для реакції, представленої у загальному вигляді пАА+пвВ = = псЗ + nDD, слідство із закону Гесса записується за допомогою рівності ΔHpя = (ніCΔHC + нDΔHD) - (nAΔHA + + nBΔHB ) і формулюється так: ентальпія реакції дорівнює алгебраїчній сумі ентальпій утворення стехіометричного кількості продуктів за вирахуванням алгебраїчної суми ентальпій утворення стехіометричного кількості реагентів. 5. Другий початок термодинаміки. Вільна енергія Гіббса Організм здійснює роботу, витрачаючи внутрішню енергію, запасену як енергії хімічного взаємодії атомів складових його речовин. Математичний вираз ΔE = Q - W першого початку термодинаміки визначає точне співвідношення між витратою внутрішньої енергії системи ΔЕ, роботою W, що здійснюється системою, та енергією Q, яка втрачається у вигляді теплоти. Однак з першого початку термодинаміки не можна визначити частину витрачається внутрішньої енергії, яка може бути перетворена на роботу. Теоретичні оцінки витрат здійснюються з урахуванням другого початку термодинаміки. Цей закон накладає суворі обмеження на ефективність перетворення енергії на роботу і, крім того, дозволяє запровадити критерії можливості мимовільного перебігу того чи іншого процесу. Процес називається мимовільним, якщо він здійснюється без будь-яких впливів, коли система надана сама собі. Існують процеси, за яких внутрішня енергія системи не змінюється (ΔЕ = 0). До таких процесів відноситься, наприклад, іонізація оцтової кислоти у воді. Цілий ряд мимовільних процесів протікає зі збільшенням внутрішньої енергії (ΔЕ > 0). Сюди відносяться, зокрема, типові реакції утворення біонеорганічних сполук альбуміну (білок плазми крові) з іонами металів, наприклад, Сu2+. Зміна внутрішньої енергії АЕ для закритих систем не може бути критерієм мимовільного перебігу процесів. Отже, першого початку термодинаміки, з якого отримано цей критерій, недостатньо для вирішення питання про самовільність, так само як і про ефективність процесів. Вирішення цих питань досягається за допомогою другого початку термодинаміки. Для формулювання другого початку термодинаміки необхідно запровадити поняття оборотного та незворотного у термодинамічному сенсі процесів. Якщо система перебуває у рівновазі, цей стан підтримується як завгодно довго за незмінності зовнішніх умов. При зміні зовнішніх умов стан системи може змінюватись, тобто в системі може протікати процес. Процес називається термодинамічно оборотним, якщо при переході з початкового стану 1 кінцевий стан 2 всі проміжні стану виявляються рівноважними. Процес називається термодинамічно незворотнім, якщо хоч один із проміжних станів нерівноважний. Оборотний процес можна здійснити лише за досить повільному зміні параметрів системи - температури, тиску, концентрації речовин та інших. Швидкість зміни параметрів має бути такою, щоб які у процесі відхилення від рівноваги були зневажливо малі. Слід зазначити, що із оборотністю пов'язана важлива проблема медицини – консервація тканин при низьких температурах. Оборотні процеси є граничним випадком реальних процесів, що відбуваються в природі і здійснюються в промисловості чи лабораторіях. 6. Другий початок термодинаміки. Ентропія Максимальна робота Wмакс, яка може бути отримана при даній спад внутрішньої енергії ΔЕ в процесі переходу зі стану 1 в стан 2, досягається лише в тому випадку, якщо цей процес оборотний. Відповідно до виразу для першого початку термодинаміки при цьому виділяється мінімальна теплота Qхв Qхв = ΔЕ - Wмакс . Максимально досяжний коефіцієнт корисної дії, що характеризує ефективність витрат внутрішньої енергії системи, відповідно дорівнює ηмакс= Шмакс / ΔЕ. При незворотному процесі переходу зі стану 1 стан 2 виконувана системою робота менше W. Щоб розрахувати максимальний коефіцієнт hмакс за відомого значення ΔЕ, необхідно знати величину Wмакс або Qхв Wмакс = ΔЕ - Qхв , отже, ηмакс = 1 - ΔЕ/Qхв . Величину Qхв можна розрахувати з урахуванням другого початку термодинаміки з допомогою термодинамічної функції стану, званої ентропією. Поняття ентропії запровадив (1865 р.) німецький фізик Р. Ю. Клаузіус (1822-1888) - один із засновників термодинаміки та молекулярнокінетичної теорії теплових процесів. Термодинамічний визначення ентропії відповідно до Клаузіуса: ентропія являє собою функцію стану, збільшення якої ΔS дорівнює теплоті Qхв підведеної до системи в оборотному ізотермічному процесі, поділеної на абсолютну температуру Т, при якій здійснюється процес: ΔS = Qхв /Т. З формули випливає, що одиниця виміру ентропії Дж/К. Прикладом оборотного ізотермічного процесу може бути повільне танення льоду в термосі з водою при 273°К. Експериментально встановлено, що для плавлення 1 молячи льоду (18 г) необхідно підвести принаймні 6000 Дж теплоти. При цьому ентропія системи "лід - вода" в термосі зростає на S = 6000 Дж: 273 ° К = 22 Дж/К. При охолодженні термоса з водою при 273 К можна повільно відвести 6000 Дж теплоти, і при кристалізації води утворюється 1 моль льоду. Для цього процесу величина Qхв у формулі має негативне значення. Відповідно, ентропія системи "лід - вода" при утворенні 1 моля льоду зменшується на ΔS =22 Дж/К. Аналогічним чином можна розрахувати зміну ентропії при будь-яких ізотермічних фізичних і хімічних процесах, якщо відома теплота, що підводиться до системи або відводиться від неї при цих процесах. Як відомо, ця теплота може бути визначена за допомогою калориметричних вимірювань. Таким чином, зміна ентропії, так само як і двох інших функцій стану системи - внутрішньої енергії та ентальпії, є експериментально визначуваною величиною. Фізичний зміст ентропії, як і внутрішньої енергії, виразно виявляється при розгляді з молекулярнокінетичної точки зору процесів, що протікають в ізольованих системах. 7. Формула Больцмана Ізольовані системи за визначенням не обмінюються із зовнішнім середовищем ні речовиною, ні енергією. Звичайно, реально таких систем у природі не існує. Однак дуже хороша ізоляція може бути здійснена, якщо помістити систему в термос, закритий пробкою. Виявляється, будь-який мимовільний процес може протікати в ізольованій системі лише в тому випадку, коли він характеризується збільшенням ентропії; у рівновазі ентропія системи постійна: ΔS ≥ 0. Це твердження, засноване на експериментальних спостереженнях, є одним із можливих формулювань другого початку термодинаміки. Процес, зворотний довільному, згідно з другим початком термодинаміки в ізольованій системі протікати не може, оскільки такий процес характеризується зменшенням ентропії. Розгляд різних ізольованих систем показує, що мимовільні процеси завжди пов'язані зі зростанням числа мікростанів w системи. У цих процесах відбувається зростання ентропії S системи, т. е. ентропія зростає зі збільшенням числа мікростанів. Вперше на існування такої залежності звернув увагу австрійський фізик Л. Больцман, який у 1872 р. запропонував співвідношення: КБ = R / NA = 1,38 – 1023 Дж/К, де ДоБ - постійна Больцмана, що дорівнює відношенню газової постійної R до постійної Авогадро NA . Це співвідношення називається формулою Больцмана. Формула Больцмана дозволяє теоретично розрахувати ентропію системи за кількістю можливих її мікростанів. Такі розрахунки добре узгоджуються з експериментально визначеними значеннями. Зокрема, відомо, що кількість мікростанів кристалічних речовин при 0°К близько до w0 1. Таким чином, можуть бути визначені абсолютні значення ентропії речовин, що кристалізуються, на відміну від внутрішньої енергії Е та ентальпії Н, для яких можна визначити лише відносні значення. Збільшення числа мікростанів системи у часто можна пов'язати зі зростанням невпорядкованості у цій системі, з переходом до можливим розподілам енергії системи. Виходячи із співвідношення Больцмана, можна дати молекулярнокінетичне визначення ентропії. Ентропія є міра ймовірності перебування системи у цьому стані чи міра невпорядкованості системи. Важливе значення поняття ентропії пов'язані з тим, що з цієї величини можна прогнозувати напрямок мимовільного перебігу процесів. Проте застосування вимірювання ентропії як критерію спрямованості процесів обмежується ізольованими системами відповідно до формулювання другого початку термодинаміки. 8. Енергія Гіббса Як критерій мимовільності процесів у відкритих і закритих системах вводиться нова функція стану - енергія Гіббса. Ця функція отримала назву на честь великого американського фізика Д. У. Гіббса (1839-1903), який вивів цю функцію, а потім використав термодинамічні роботи. Енергія Гіббса визначається через ентальпію Н та ентропію S за допомогою співвідношень: G = H - S, ΔG = ΔH - ΔS. На основі енергії Гіббса другий початок термодинаміки можна сформулювати наступним чином: в ізобарноізотермічних умовах (р, Т = const) у системі мимовільно можуть здійснюватися тільки такі процеси, в результаті яких енергія Гіббса системи зменшується (ΔG <0). У стані рівноваги енергія Гіббса системи не змінюється (G = const, AG = 0). ΔG<0, р, Т = const. Зі викладеного випливає, що енергія Гіббса відіграє велику роль у вивченні біоенергетичних процесів. За допомогою цієї функції стану можна прогнозувати напрямок мимовільних процесів у біологічних системах та розраховувати максимально досяжний ККД. Енергія Гіббса G так само, як і ентальпія Н, є функцією стану системи. Тому зміна енергії Гіббсу ΔG може використовуватися для характеристики хімічних перетворень аналогічно до зміни ентальпії ΔН. Рівняння реакції, для яких вказується зміна енергії Гіббса, що відповідає цим реакціям, також називаються термохімічними. Хімічні реакції, при протіканні яких відбувається зменшення енергії Гіббса системи (ΔG < 0) і відбувається робота, називаються екзергонічними. Реакції, у яких енергія Гіббса зростає (ΔG > 0) і над системою відбувається робота, називаються ендергонічними. Виведена з урахуванням другого початку термодинаміки енергія Гіббса є функцією стану. Отже, так само, як і для ентальпії, може бути сформульований закон Гесса для енергії Гіббса у наступній формі: зміна енергії Гіббса при утворенні заданих продуктів з даних реагентів при постійних тиску та температурі не залежить від числа та виду реакцій, в результаті яких утворюються ці продукти. Важливим прикладом застосування закону Гесса є розрахунок енергії Гіббса реакції окислення глюкози дикислородом. Зміна енергії Гіббса в цій реакції при р = 101 кПа і Т = 298 К, певне поза організмом, дорівнює ΔG ° = 2880 кДж/моль. Відповідне термохімічне рівняння записується у вигляді: С6Н12О6 + 6О2 = 6СО2 + 6Н2О, ΔGpя° = 2880 кДж/моль. У клітинах організму ця реакція здійснюється через низку послідовних стадій, вивчених біохіміками. Можна передбачити, виходячи з закону Гесса, що сума змін енергії Гіббса у всіх проміжних реакціях дорівнює ΔGpя: ΔG1 +ΔG2 +ΔG3 + … + ΔGn = ΔGpя °. Енергія Гіббса реакції дорівнює алгебраїчній сумі енергій Гіббсу утворення стехіометричної кількості продуктів за вирахуванням алгебраїчної суми енергій Гіббсу утворення стехіометричної кількості реагентів: ΔGpя = (ніcΔGc + нDΔGD)(nAΔGA + нBΔGB). 9. Розчини. Класифікація розчинів За агрегатним станом розчини можуть бути газоподібними, рідкими та твердими. Будь-який розчин складається з розчинених речовин та розчинника, хоча ці поняття певною мірою умовні. Наприклад, залежно від співвідношення кількості спирту та води ця система може бути розчином спирту у воді або води у спирті. Зазвичай розчинником вважають компонент, який у розчині знаходиться в тому ж агрегатному стані, що і до розчинення. Вчення про розчини становить для медиків особливий інтерес тому, що найважливіші біологічні рідини – кров, лімфа, сеча, слина, піт є розчинами солей, білків, вуглеводів, ліпідів у воді. Біологічні рідини беруть участь у транспорті поживних речовин (жирів, амінокислот, кисню), лікарських препаратів до органів та тканин, а також у виведенні з організму метаболітів (сечовини, білірубіну, вуглекислого газу тощо). Плазма крові є середовищем для клітин – лімфоцитів, еритроцитів, тромбоцитів. У рідких середовищах організму підтримується сталість кислотності, концентрації солей та органічних речовин. Така сталість називається концентраційним гомеостазом. Класифікація розчинів Розчини речовин із молярною масою менше 5000 г/моль називаються розчинами низькомолекулярних сполук (НМС), а розчини речовин із молярною масою більше 5000 г/моль – розчинами високомолекулярних сполук (ВМС). За наявності чи відсутності електролітичної дисоціації розчини НМС поділяють на два класи - розчини електролітів та неелектролітів. Розчини електролітів - розчини, що дисоціюють на іони солей, кислот, основ, амфолітів. Наприклад, розчини KNО3, HCl, КОН, Аl(ВІН)3 , гліцину. Електрична провідність розчинів електролітів вища, ніж розчинника. Розчини неелектролітів - розчини речовин, що практично не дисоціюють у воді. Наприклад, розчини сахарози, глюкози, сечовини. Електрична провідність розчинів неелектроліт мало відрізняється від розчинника. Розчини НМС (електролітів та неелектролітів) називаються істинними на відміну від колоїдних розчинів. Справжні розчини характеризуються гомогенністю складу та відсутністю поверхні поділу між розчиненою речовиною та розчинником. Розмір розчинених частинок (іонів та молекул) менше 109м. Більшість ВМС - полімери, молекули яких (макромолекули) складаються з великої кількості групувань, що повторюються, або мономерних ланок, з'єднаних між собою хімічними зв'язками. Розчини ВМС називають розчинами поліелектролітів. До поліелектролітів належать полікислоти (гепарин, поліаденілова кислота, поліаспарагінова кислота та ін), поліоснови (полілізин), поліамфоліти (білки, нуклеїнові кислоти). Властивості розчинів ВМС значно відрізняються від властивостей розчинів НМС. Тому їх буде розглянуто в окремому розділі. Даний розділ присвячений розчинам низькомолекулярних електролітів, амфолітів і неелектролітів. 10. Вода як розчинник Найпоширенішим розчинником на планеті є вода. Тіло середньої людини масою 70 кг містить приблизно 40 кг води. При цьому близько 25 кг води припадає на рідину всередині клітин, а 15 кг становить позаклітинна рідина, в яку входять плазма крові, міжклітинна рідина, спинномозкова рідина, внутрішньоочна рідина та рідкий вміст шлунково-кишкового тракту. У тварин і рослинних організмів вода зазвичай становить понад 50%, а в ряді випадків вміст води досягає 90-95%. Внаслідок своїх аномальних властивостей вода – унікальний розчинник, чудово пристосований для життєдіяльності. Насамперед вода добре розчиняє іонні та багато полярних сполук. Така властивість води пов'язана значною мірою з її високою діелектричною проникністю (78,5). Інший численний клас речовин, добре розчинних у воді, включає такі полярні органічні сполуки, як цукри, альдегіди, кетони, спирти. Їх розчинність у воді пояснюється схильністю молекул води до утворення полярних зв'язків з функціональними полярними групами цих речовин, наприклад з гідроксильними групами спиртів і цукрів або з атомом кисню карбонільної групи альдегідів і кетонів. Нижче наведено приклади водневих зв'язків, важливих для розчинності речовин у біологічних системах. Внаслідок високої полярності вода спричиняє гідроліз речовин. Оскільки вода становить основну частину внутрішнього середовища організму, вона забезпечує процеси всмоктування, пересування поживних речовин і продуктів обміну в організмі. Слід зазначити, що вода є кінцевим продуктом біологічного окислення речовин, зокрема глюкози. Утворення води внаслідок цих процесів супроводжується виділенням великої кількості енергії - приблизно 29 кДж/моль. Важливими є й інші аномальні властивості води: високий поверхневий натяг, низька в'язкість, високі температури плавлення та кипіння і вища щільність у рідкому стані, ніж у твердому. Для води характерна наявність асоціатів – груп молекул, з'єднаних водневими зв'язками. Залежно від спорідненості до води функціональні групи часток, що розчиняються, поділяються на гідрофільні (притягують воду), легко сольватуються водою, гідрофобні (відштовхуючі воду) і дифільні. До гідрофільних груп відносяться полярні функціональні групи: гідроксильна-ОН, аміно-NH2 , тіольна-SH, карбоксильна-СООН. До гідрофобних - неполярні групи, наприклад, вуглеводневі радикали: СНз-(СН)2)п -, С6Н5 -. До дифільних відносять речовини (амінокислоти, білки), молекули яких містять гідрофільні групи (-ОН, -NH2 , -SH, -СООН), так і гідрофобні групи: (СН3 - (СН2)п ,-С6Н5-). При розчиненні дифільних речовин відбувається зміна структури води як наслідок взаємодії з гідрофобними групами. Ступінь упорядкування молекул води, близьких до гідрофобних груп, збільшується, і контакт молекул води з гідрофобними групами зводиться до мінімуму. Гідрофобні групи, асоціюючись, виштовхують молекули води з свого розташування. 11. Концентрація розчину та способи її вираження розчином називається гомогенна система змінного складу, що знаходиться в стані рівноваги, з двох або більше речовин. Речовини, що становлять розчин, називаються компонентами розчину. Важливою характеристикою розчину концентрація. Цією величиною визначаються багато властивостей розчину. Концентрацією речовини (компонента розчину) називається величина, що вимірюється кількістю розчиненої речовини, що міститься в певній масі або об'ємі розчину або розчинника. Найчастіше застосовувані способи вираження концентрації: масова частка, молярна концентрація, молярна концентрація еквівалента, молярна частка, об'ємна частка, титр. Масову частку W(Х) виражають у частках одиниці, відсотках (%), проміле (тисячній частині відсотка) та у мільйонних частках (млн-1). Масову частку розраховують за формулами: W(Х) = м(Х)/m (рр), W(Х) = м(Х)/m (рр) × 100%, де m(Х) - Маса даного компонента X (розчиненої речовини), кг (г); м (рр) - маса розчину, кг (г). Молярну концентрацію виражають у моль/м3 , моль/дм3 , моль/см3 , моль/л, моль/мл. У медицині краще застосування одиниць моль/л. Молярну концентрацію розраховують за такою формулою: C(Х) = ні(Х)/V(pp) = м(Х)/M(Х) × В(рр), де n(Х) - кількість розчиненої речовини системи, моль; M(Х) - молярна маса розчиненої речовини, кг/моль або г/моль; m(Х) - Маса розчиненої речовини відповідно, кг або р; V(рр) - Об'єм розчину, л. Молярну концентрацію b(Х) виражають у одиницях моль/кг. Форма запису, наприклад: Ь(НСl) = 0,1 моль/кг. Розраховують молярну концентрацію за формулою: b(Х) = ні(Х)/m(Рль) = м(Х)/M(Х) × м(Рль) де m(Рль) - Маса розчинника, кг. У хімії широко використовують поняття еквівалента та фактора еквівалентності. Еквівалентом називається реальна або умовна частка речовини X, яка в даній кислотно-основної реакції еквівалентна одному іону водню або в даній окислювально-відновної реакції - одному електрону, або в даній обмінній реакції між солями - одиниці заряду. Об'ємну частку ф(Х) виражають у частках одиниці або у відсотках, її розраховують за формулою: Ф(Х) = V(Х)/ В.(рр) де V(Х) - Об'єм даного компонента Х розчину; V(рр) - загальний об'єм розчинника. Титр розчину позначають Т(Х), одиниця виміру - кг/см3 , г/см3 , г/мл. Титр розчину можна розрахувати за такою формулою: Т(Х) = м(Х)/ В.(рр) де m(Х) - Маса речовини, зазвичай г; V(рр) об'єм розчину, мл. 12. Процес розчинення Природа процесу розчинення складна. Звичайно, виникає питання, чому деякі речовини легко розчиняються в одних розчинниках і погано розчиняються або практично нерозчинні в інших. Утворення розчинів завжди пов'язані з тими чи іншими фізичними процесами. Одним з таких процесів є дифузія розчиненої речовини та розчинника. Завдяки дифузії частинки (молекули, іони) видаляються з поверхні речовини, що розчиняється, і рівномірно розподіляються по всьому об'єму розчинника. Саме тому відсутність перемішування швидкість розчинення залежить від швидкості дифузії. Однак не можна лише фізичними процесами пояснити неоднакову розчинність речовин у різних розчинниках. Великий російський хімік Д. І. Менделєєв (1834-1907) вважав, що важливу роль при розчиненні грають хімічні процеси. Він довів існування гідратів сірчаної кислоти H2СО4H2О, Х2СО42H2О, Х2СО44H2Про та деякі інші речовини, наприклад,2Н5ОН3Н2О. У цих випадках розчинення супроводжується утворенням хімічних зв'язків частинок речовини, що розчиняється, і розчинника. Цей процес називається сольватацією, в окремому випадку, коли розчинником є вода, - гідратацією. Як встановлено, залежно від природи розчиненої речовини сольвати (гідрати) можуть утворюватися в результаті фізичних взаємодій: іондипольної взаємодії (наприклад, при розчиненні речовин з іонною структурою (NaCI та ін.); дипольдипольної взаємодії - при розчиненні речовин з молекулярною структурою (органічні речовини) )). Хімічні взаємодії здійснюються з допомогою донорноакцепторних зв'язків. Тут іони розчиненої речовини є акцепторами електронів, а розчинники (Н2О, NН3) - донорами електронів (наприклад, утворення аквакомплексів), а також внаслідок утворення водневих зв'язків (наприклад, розчинення спирту у воді). Доказами хімічної взаємодії розчиненої речовини з розчинником є теплові ефекти та зміна забарвлення, що супроводжують розчинення. Наприклад, при розчиненні гідроксиду калію у воді виділяється теплота: КОН + хН2О = КОН(Н2О)х; ΔН°розтв = 55 кДж/моль. А при розчиненні натрію хлориду теплота поглинається: NaCI + хН2Про = NaCI(H2О)х; ΔН°розтв = +3,8 кДж/моль. Теплота, що виділяється або поглинається при розчиненні 1 молячи речовини, називається теплотою розчинення Qрозтв Відповідно до першого початку термодинаміки Qрозтв = ΔНрозтв, де ΔНрозтв - Зміна ентальпії при розчиненні даної кількості речовини. Розчинення у воді безводного сульфату міді білого кольору призводить до появи інтенсивного блакитного забарвлення. Утворення сольватів, зміна забарвлення, теплові ефекти, як і низка інших факторів, свідчать про зміну хімічної природи компонентів розчину під час його утворення. Таким чином, відповідно до сучасних уявлень, розчинення - фізикохімічний процес, в якому відіграють роль як фізичні, так і хімічні види взаємодії. 13. Термодинаміка процесу розчинення Відповідно до другого початку термодинаміки при р, Т = = const речовини мимовільно можуть розчинятися в якомусь розчиннику, якщо в результаті цього процесу енергія Гіббса системи зменшується, тобто. ΔG = (ΔН - TΔS) < 0. Величину ΔН називають ентальпійним фактором, а величину ΔS - ентропійним фактором розчинення. При розчиненні рідких і твердих речовин ентропія системи зазвичай зростає (ΔS > 0), так як речовини, що розчиняються, з більш упорядкованого стану переходять у менш впорядковане. Вклад ентропійного фактора, що сприяє збільшенню розчинності, особливо помітний при підвищених температурах, тому що в цьому випадку множник Т великий і абсолютне значення твору T S також велике, відповідно зростає спад енергії Гіббса. При розчиненні газів у рідині ентропія системи зазвичай зменшується (ΔS < 0), так як розчиняється речовина з менш впорядкованого стану (великого обсягу) переходить у більш впорядковане (малий обсяг). Зниження температури сприяє розчиненню газів, тому що в цьому випадку множник Т малий і абсолютне значення твору TΔS буде тим менше, а зменшення енергії Гіббса тим більше, чим нижче значення Т. У процесі утворення розчину ентальпія системи також може збільшуватися (NaCI), так і зменшуватися (КОН). Зміну ентальпії процесу розчинення слід розглядати відповідно до закону Гесса як алгебраїчну суму ендо та екзотермічних вкладів усіх процесів, що супроводжують процес розчинення. Це ендотермічні ефекти руйнування кристалічних ґрат речовин, розриву зв'язку молекул, руйнування вихідної структури розчинника та екзотермічні ефекти утворення різних продуктів взаємодії, у тому числі сольватів. Для простоти викладу збільшення ентальпії розчинення ΔНрозтв можна уявити як різницю енергії Екр, що витрачається на руйнування кристалічних ґрат розчинної речовини, та енергії Есол, Що виділяється при сольватації частинок розчиненої речовини молекулами розчинника Інакше висловлюючись, зміна ентальпії є алгебраїчну суму зміни ентальпії ΔНкр внаслідок руйнування кристалічних ґрат і зміни ентальпії ΔНсол за рахунок сольватації частинками розчинника: ΔНрозтв = ΔНкр + ΔНсол, де ΔНрозтв - Зміна ентальпії при розчиненні. Однак розчинення благородних газів в органічних розчинниках нерідко супроводжується поглинанням теплоти, наприклад гелію та неону в ацетоні, бензолі, етанолі, циклогексані. При розчиненні твердих речовин з молекулярною кристалічною структурою та рідин молекулярні зв'язки не дуже міцні, і тому зазвичай ΔНсол > ΔНкр Це призводить до того, що розчинення, наприклад, спиртів і цукрів є екзотермічний процес (ΔНрозтв <0). При розчиненні твердих речовин з іонними ґратами співвідношення енергій Екр та Есол можуть бути різними. Однак у більшості випадків енергія, що виділяється при сольватації іонів, не компенсує енергію, що витрачається на руйнування кристалічних ґрат, отже, і процес розчинення є ендотермічним. Таким чином, термодинамічні дані дозволяють прогнозувати мимовільне розчинення різних речовин на основі першого та другого початків термодинаміки. 14. Розчинність Якщо розчинна речовина контактує з розчинником, процес утворення розчину в багатьох випадках йде мимовільно доти, доки не досягається деяка гранична концентрація (настає насичення). Це відбувається при досягненні рівноваги, коли ентальпійний та ентропійний фактори зрівняються, тобто ΔН = TΔS. Наприклад, при внесенні кристалів у рідину з поверхні кристала розчин переходять молекули або іони. Внаслідок дифузії частинки рівномірно розподіляються по всьому об'єму розчинника. Розчин іде до насичення. Розчин, що містить при даній температурі максимальну кількість розчиненої речовини і що знаходиться в рівновазі з надлишком речовини, що розчиняється, називається насиченим. Перенасичений розчин - розчин, концентрація якого вища, ніж насиченому. Розчин із меншою концентрацією, ніж насичений, називають ненасиченим. Здатність речовини розчинятися у тому чи іншому розчиннику називається розчинністю. Чисельно розчинність речовини дорівнює концентрації його насиченого розчину. Розчинність може бути виражена в тих же одиницях, що і концентрація, наприклад, через кількість розчиненої речовини, що міститься в 1 л насиченого розчину, моль/л, або через масу розчиненої речовини в 100 г насиченого розчину. Одиницею розчинності є грам на 100 г розчинника. Відповідна величина називається коефіцієнтом розчинності. Розчинність залежить від природи речовини, що розчиняється, і розчинника, температури, тиску, присутності в розчині інших речовин. Вплив на розчинність природи компонентів Здатність розчинятися визначається характером сил взаємодії між молекулами компонентів розчину X1 та Х2 : розчинник - розчинник (X1 - Х1 ), розчинена речовина - розчинена речовина (Х2 - Х2 ), розчинник - розчинена речовина (Х1 - Х2 ) (точки позначають молекулярний зв'язок). Розчинність речовин коливається у межах. У прикладах наведена розчинність різних солей в тому самому розчиннику (воді) і розчинність однієї і тієї ж речовини (AgNО3 ) у різних розчинниках. Речовини з іонним типом зв'язку та речовини, що складаються з полярних молекул, краще розчиняються у полярних розчинниках, таких як вода, спирти. Ці розчинники характеризуються високою діелектричною проникністю. Висока розчинність речовин часто обумовлена утворенням міжмолекулярних, зокрема водневих, зв'язків. Так, необмежена взаємна розчинність води та спирту пояснюється утворенням водневих зв'язків між молекулами води та спирту, а розчинення кристалів AgcI у водному розчині аміаку пояснюється утворенням хімічного донорноакцепторного зв'язку іона срібла з молекулами аміаку (AgCI у воді практично нерозчинний). З цієї причини в пиридине - розчиннику з низькою діелектричною проникністю - виявляється дуже висока розчинність. Оскільки розчинність характеризує справжню рівновагу, вплив зовнішніх умов цей стан (тиску, температури) можна якісно оцінити, скориставшись принципом Ле Шательє. Подібні оцінки необхідні у практиці глибоководних занурень, під час роботи у гарячих цехах тощо. 15. Розчинність газів у рідинах. Закони Генрі-Дальтона та Сєченова Розчинення газів у рідинах майже завжди супроводжується виділенням теплоти. Тому розчинність газів із підвищенням температури згідно з принципом Ле Шательє знижується. Цю закономірність часто використовують для видалення розчинених газів з води (наприклад, С02) кип'ятінням. Іноді розчинення газу супроводжується поглинанням теплоти (наприклад, розчинення шляхетних газів деяких органічних розчинниках). У цьому випадку підвищення температури збільшує розчинність газу. Газ не розчиняється у рідині безмежно. При певній концентрації газу X встановлюється рівновага:  При розчиненні газу рідини відбувається значне зменшення обсягу системи. Тому підвищення тиску згідно з принципом Ле Шательє має призводити до зміщення рівноваги вправо, тобто збільшення розчинності газу. Якщо газ малорозчинний у цій рідині і тиск невеликий, то розчинність газу пропорційна його тиску. Ця залежність виражається законом Генрі (1803г.): кількість газу, розчиненого при даній температурі у певному обсязі рідини, при рівновазі прямо пропорційно тиску газу. Закон Генрі може бути записаний у такій формі: с (Х) = Кr(X) × П(Х) де - концентрація газу насиченому розчині, моль/л; P(Х) - Тиск газу X над розчином, Па; Kr(X) - постійна Генрі для газу X, моль×л1 × Па1 . Константа Генрі залежить від природи газу, розчинника та температури. Закон Генрі справедливий лише для порівняно розбавлених розчинів, при невисоких тисках і відсутності хімічної взаємодії між молекулами газу, що розчиняється, і розчинником. Закон Генрі є окремим випадком загального закону Дальтона. Якщо йдеться про розчинення не однієї газоподібної речовини, а суміші газів, то розчинність кожного компонента підпорядковується закону Дальтона: розчинність кожного з компонентів газової суміші за постійної температури пропорційна парціальному тиску компонента над рідиною і не залежить від загального тиску суміші та індивідуальності інших компонентів. Інакше кажучи, у разі розчинення суміші газів у рідині в математичний вираз закону Генрі замість підставлять парціальний тиск р! даного компонента. Під парціальним тиском компонента розуміють частку тиску компонента від загального тиску газової суміші: Рi/ Рзагальний Парціальний тиск компонента розраховують за формулою Вивчаючи розчинність газів у рідинах у присутності електролітів, російський лікар-фізіолог І. М. Сєченов (1829-1905) встановив таку закономірність (закон Сєченова): розчинність газів у рідинах у присутності електролітів знижується; відбувається висолення газів. Рi = Рзагальний ×(Xi) де pi - парціальний тиск компонента Хi; Рзагальний загальний тиск газової суміші; х(Хi) - молярна частка iого компонента. Вивчаючи розчинність газів у рідинах у присутності електролітів, російський лікар-фізіолог І. М. Сєченов (1829-1905) встановив таку закономірність (закон Сєченова): розчинність газів у рідинах у присутності електролітів знижується; відбувається висолення газів. 16. Роль дифузії у процесах перенесення речовин у біологічних системах Дифузія відіграє у біологічних системах. Насамперед переміщення поживних речовин та продуктів обміну в тканинних рідинах відбувається за допомогою дифузії. Крім того, у багатьох випадках швидкість фізикохімічних процесів у живих організмах визначається швидкістю дифузії реагуючих речовин, оскільки дифузія реагентів, як правило, є найбільш повільною стадією процесу, тоді як біохімічні реакції за участю ферментів протікають дуже швидко. Будь-яка жива клітина оточена мембраною, яка служить для захисту та регуляції внутрішньоклітинного середовища. Речовини проходять через мембрани за двома основними механізмами: шляхом звичайної дифузії (пасивний транспорт) та енергетично активованого перенесення (активний транспорт). Внутрішній шар мембрани складається із вуглеводневих ланцюгів. Тому багато невеликих нейтральних молекул і неполярних молекул НМС розчиняються в цьому шарі і можуть проходити через мембрану шляхом звичайної дифузії по градієнту концентрації. Такий транспорт речовин називається пасивним. Дифузія відіграє велику роль у процесі насичення крові киснем у легенях. Внаслідок великої розгалуженості поверхня альвеол легень велика (~ 80 м2), тому кисень активно розчиняється у плазмі та потрапляє в еритроцити. Венозна кров збіднена киснем - концентрація кисню у венозній крові прагне нуля. Отже, градієнт концентрації кисню між атмосферою та кров'ю, що надходить у легені, високий, що призводить до активного поглинання (за законом Фіка). Перенесення речовин із області із меншою концентрацією в область із більшою концентрацією проти градієнта називається активним транспортом. Такий процес не може йти мимоволі і потребує енергетичних витрат. Джерелом енергії є екзоергонічна реакція гідролізу біонеорганічної сполуки – аденозинтрифосфату (АТФ). Стійкий стаціонарний розподіл концентрацій іонів всередині і поза клітини досягається, коли потік іонів через мембрану всередину клітини стає рівним потоку іонів з клітини, що виникає внаслідок пасивної дифузії. Аналогічно досягається розподіл (іонний гомеостаз) і для іонів Na, тільки активний транспорт і пасивна дифузія іонів, що компенсує, спрямовані протилежно відповідним потокам іонів До. Процес дифузії знаходить широке застосування у медицині. Так, наприклад, метод діалізу, заснований на вибірковості дифузії низькомолекулярних речовин через напівпроникну мембрану вздовж градієнта концентрації, використовується в клінічній практиці при створенні апарату "штучна нирка". Частинки ВМС не проходять через напівпроникну мембрану, тому біологічні рідини (наприклад, плазму крові) можна методом діалізу очистити від шкідливих низькомолекулярних речовин - "шлаків" (сечовини, сечової кислоти, білірубіну, амінів, надлишку іонів К), що накопичуються при різних захворюваннях. При очищенні кров хворого, відведена з вени, надходить у спеціальні камери з напівпроникними мембранами, якими НМС можуть дифундувати і видалятися з плазми. При ряді запальних захворювань відбувається деструкція білків, і в плазмі крові поряд з НМС є фрагменти білка (пептиди та поліпептиди), які також потрібно видаляти. 17. Зниження температури замерзання та підвищення температури кипіння розчинів Прямим наслідком зниження тиску пари над розчином є зміна температури замерзання ΔТз та температури кипіння розчинів ΔТк порівняно із значеннями цих величин для чистого розчинника. Співвідношення між цими величинами також випливають із другого початку термодинаміки. Температурою кипіння рідини є температура, при якій тиск її парів стає рівним зовнішньому тиску (при 101,3 кПа температура кипіння води дорівнює 100 °С). Температурою замерзання (кристалізації) рідини є температура, при якій тиск пари над рідиною дорівнює тиску пари над твердою фазою. Якщо позначити температури замерзання та кипіння розчину Т3 і Тк, а ці ж величини для розчинника Т°3 і Т°к , то отримаємо: ΔТк = Тк - Т°к > 0, ΔТ3 = Т°3 - Т3 > 0. Ефекти підвищення температури кипіння та зниження температури замерзання розчинів якісно можуть бути пояснені за допомогою принципу Ле Шательє. Дійсно, якщо в рівноважну систему "рідина - пара" (наприклад, Н2О(Ж) - Н2О(Г)), ввести розчинну нелетючу речовину, то тиск пари розчинника над розчином зменшиться. Щоб компенсувати зниження тиску пари і досягти колишнього рівноважного стану, розчин потрібно нагріти до вищої температури (більше 373 ° К), так як ендотермічний процес. Нехай є рівноважна система "тверда фаза - рідина", наприклад, Н2О(Т) > Н2О(Ж), за 273°К. Якщо розчинити в рідкій фазі деяку кількість не летючої речовини (нерозчинної у твердій фазі), то концентрація молекул води в рідкій фазі зменшиться. Відповідно до принципу Ле Шательє почне йти процес, який збільшує кількість води в рідкій фазі, - плавлення льоду. Для встановлення нової рівноваги розчин необхідно охолодити, тобто знизити температуру, оскільки процес екзотермічний. За законом Рауля для розведених розчинів зниження тиску пари пропорційно концентрації розчину. Отже, підвищення температури кипіння та зниження температури замерзання таких розчинів має зростати зі збільшенням їхньої концентрації. Вивчаючи замерзання та кипіння розчинів, Рауль встановив: підвищення температури кипіння ΔТк та зниження температури замерзання ΔТ3 розведених розчинів неелектролітів прямо пропорційно до молярної концентрації розчину: ΔТк =Доэb(x), ΔТ3 = Доз b(x), де b(Х) - молярна концентрація, моль/кг; Кз і Кэ - Коефіцієнти пропорційності, кг × К × моль1 , які називаються відповідно ебуліометричною та кріометричною константами. Фізичний зміст констант Кэ і Кз стає зрозумілим, якщо прийняти b(Х) = 1. Тоді Кэ = ΔТк , а Доз = ΔТз . Інакше висловлюючись, эбулиометрическая константа чисельно дорівнює підвищенню температури кипіння одномолярного розчину, а константа криометрическая - зниження температури замерзання одномолярного розчину. Ебуліометричні та кріометричні константи залежать тільки від природи розчинника та не залежать від природи розчиненої речовини (ідеальні розчини). 18. Осмотичний тиск Осмосом називається переважно одностороннє проникнення молекул розчинника (дифузія) через напівпроникну мембрану з розчинника в розчин або з розчину з меншою концентрацією розчин з більшою концентрацією. Необхідною умовою виникнення осмосу є наявність розчинника та розчину або двох розчинів різної концентрації, розділених напівпроникною мембраною. З точки зору термодинаміки рушійною силою осмосу є прагнення системи до вирівнювання концентрацій, тому що при цьому ентропія системи зростає, оскільки система переходить у менш упорядкований стан, енергія Гіббса системи відповідно зменшується, хімічні потенціали вирівнюються. Тому осмос – мимовільний процес. Ілюстрацією, що пояснює зв'язок механізму осмосу зі зміною тиску пари над розчином, може бути простий досвід. Якщо в закриту скляну посудину помістити склянку з чистим розчинником і склянку з розчином будь-якої нелетючої речовини (рівні рідин у судинах однакові), то через деякий час рівень рідини в першій склянці знизиться, а рівень розчину в другій склянці підвищиться. В цьому випадку відбувається перехід розчинника з першої склянки в другу склянку, що обумовлено (за законом Рауля) нижчим тиском пари розчинника над розчином, ніж чистим розчинником. Таким чином, повітряний простір між розчинником та розчином виконує роль напівпроникної мембрани. Наповнимо посудину з напівпроникними стінками водним розчином глюкози і помістимо в іншу посудину з водою так, щоб рівні рідин у цих судинах збігалися. В результаті осмосу об'єм розчину в першій посудині збільшується і рівень рідини в цій посудині поступово підвищується. При цьому створюється додатковий гідростатичний тиск, що перешкоджає осмосу. Гідростатичний тиск стовпа рідини при осмотичній рівновазі визначає осмотичний тиск розчину. Осмотичний тиск називається величина, що вимірюється мінімальним гідравлічним тиском, який потрібно докласти до розчину, щоб осмос припинився. Закони осмотичного тиску. Вантгофф запропонував емпіричне рівняння для розрахунку осмотичного тиску розведених розчинів неелектролітів: π = С(Х)RT, де - осмотичний тиск, кПа; С(Х) - молярна концентрація, моль/л; R - універсальна газова постійна, рівна 8,31 кПа - л/(моль - К); Т – абсолютна температура, До. Хоча закон Вант-Гоффа був встановлений на основі експериментальних даних, він може бути виведений з умов термодинамічної рівноваги при G = 0. Тому цей закон слід розглядати як наслідок другого початку термодинаміки. Вираз у вищевказаній формі аналогічний рівнянню Клапейрона-Менделєєва для ідеальних газів, проте ці рівняння описують різні процеси. 19. Роль осмосу та осмотичного тиску в біологічних системах Явище осмосу відіграє у багатьох хімічних і біологічних системах. Завдяки осмосу регулюється надходження води в клітини та міжклітинні структури. Пружність клітин (тургор), що забезпечує еластичність тканин та збереження певної форми органів, зумовлена осмотичним тиском. Тварини та рослинні клітини мають оболонки або поверхневий шар протоплазми, що мають властивості напівпроникних мембран. При поміщенні цих клітин розчини з різною концентрацією спостерігається осмос. Розчини, що мають однаковий осмотичний тиск, називаються ізотонічними. Якщо два розчини мають різний осмотичний тиск, то розчин з великим осмотичним тиском є гіпертонічним по відношенню до другого, а другий - гіпотонічним по відношенню до першого. При поміщенні клітин у ізотонічний розчин вони зберігають свій розмір та нормально функціонують. При поміщенні клітин у гіпотонічний розчин вода з менш концентрованого зовнішнього розчину переходить усередину клітин, що призводить до їх набухання, а потім до розриву оболонок та витікання клітинного вмісту. Таке руйнування клітин називається лізисом, у разі еритроцитів цей процес називається гемолізом. Кров із клітинним вмістом, що виходить назовні при гемолізі, за свій колір називається лаковою кров'ю. При поміщенні клітин у гіпертонічний розчин вода з клітин іде у більш концентрований розчин, і спостерігається зморщування (висушування) клітин. Це називається плазмолізом. Біологічні рідини людини (кров, лімфа, тканинні рідини) є водними розчинами низькомолекулярних сполук - NaCI, KCl, СаС1, високомолекулярних сполук - білків, полісахаридів, нуклеїнових кислот і формених елементів - еритроцитів, лейкоцитів, тромбоцитів. Їхньою сумарною дією визначається осмотичний тиск біологічних рідин. Осмотичний тиск крові людини при 310 ° К (37 ° С) становить 780 кПа (7,7 атм). Такий же тиск створює і 0,9% водний розчин NaCI (0,15 моль/л), який, отже, ізотонічний з кров'ю (фізіологічний розчин). Однак у крові крім іонів Na та С1 є й інші іони, а також ВМС та формені елементи. Тому в медичних цілях більш правильно використовувати розчини, що містять ті ж компоненти і в тій же кількості, що входять до складу крові. Ці розчини застосовують як кровозамінники в хірургії. Людський організм, крім осмотичного тиску, характеризується сталістю (гомеостазом) та інших фізикохімічних показників крові, наприклад, кислотності. Допустимі коливання осмотичного тиску крові дуже незначні і навіть при тяжкій патології не перевищують кількох десятків кПа. При різних процедурах у кров людини та тварин у великих кількостях можна вводити лише ізотонічні розчини. При великих втрат крові (наприклад, після тяжких операцій, травм) хворим вводять по кілька літрів ізотонічного розчину для відшкодування втрати рідини з кров'ю. Явище осмосу широко використовують у медичній практиці. Так, у хірургії застосовують гіпертонічні пов'язки (марлю, змочену в гіпертонічному 10% розчині NaCl), які вводять у гнійні рани. За законом осмосу струм рідини рани через марлю прямує назовні, внаслідок чого рана постійно очищається від гною, мікроорганізмів та продуктів розпаду. 20. Ступінь дисоціації (іонізації). Сила електролітів Електроліти, які практично повністю дисоціюють на іони (іонізуються), називаються сильними, а електроліти, які не повністю іонізуються – слабкими. У розчині слабких електролітів поруч із іонами існують неіонізовані молекули. Саме неповною іонізацією С. Арреніус пояснив, чому ізотонічний коефіцієнт розчинів слабких електролітів не дорівнює цілому числу. Для кількісної характеристики повноти дисоціації запроваджено поняття ступеня дисоціації (іонізації). Ступенем дисоціації (іонізації) електроліту називається відношення числа молекул, що розпалися на іони, до загального числа його молекул, введених у розчин. Інакше висловлюючись, ан - частка молекул електроліту, розпавшихся на іони. Ступінь дисоціації ан виражається у відсотках чи частках одиниці: αн = Nн/ Np, де N - число молекул електроліту, що розпалися на іони; Np число молекул електроліту, введених у розчин (розчинених). Так, для С(СНзСООН) = 0,1 моль/л, ступінь дисоціації αн = 0,013 (або 1,3%). За ступенем дисоціації електроліти умовно поділяють на сильні (αн > 30%) та слабкі (αн <3%). У проміжку електроліти вважаються середньої сили. До сильних електролітів відносять майже всі солі. З найважливіших кислот і основ до них належать H2SO4 , HCI, НВг, HI, HNO3 , NaOH, КОН,(ОН)2 . До слабких електролітів належить більшість органічних кислот, а також деякі неорганічні сполуки - H2S, HCN, Н2СО3 , SО3 , НСl0, Н2O, Н3ВО3 , Рт2CI2 , Fe(SCN)3 . Експериментально ан визначають, вимірюючи відхилення колгативних властивостей розчинів електролітів від теоретичних висимостей для ідеальних розчинів. Наприклад, кріоскочеським методом визначають ізотонічний коефіцієнт i, потім розраховують ступінь дисоціації Для сильних ектролітів ступінь дисоціації є здається, так вони дисоціюють на іони практично повністю. Відхилення ізотонічного коефіцієнта i від цілих знань пояснюється для них не присутністю в розчині несоційованих молекул, а іншими причинами. Дисоціація супроводжується виділенням чи поглинанням теплоти. Отже, ступінь дисоціації має висіти від температури. Вплив температури можна оцінити за принципом Ле Шательє. Якщо електролітична дисціація протікає з поглинанням теплоти, то підвищенням мператури aн збільшується, якщо з виділенням теплоти, aн зменшується. На ступінь електролітичної дисоціації впливає коннтрація розчину. При розведенні розчину ступінь дисоціації значно зростає. У зв'язку з цим зазначена класифікація сили електролітів за ступенем дисоціації αн справедлива лише розчинів з концентрацією порядку 0,1 моль/л. Якщо розглядати електролітичну дисоціацію як рівноважний оборотний процес, то відповідно до принципу Ле Шательє розведення водою збільшує кількість дисцильованих молекул, тобто ступінь дисоціації зростає. На ступінь дисоціації слабких електролітів впливає додавання однойменних іонів. Так, введення в рівноважну стему несильного електроліту збільшує концентрацію іонів, що відповідно до принципу Ле Шательє призводить до значного зрушення рівноваги дисоціації вліво, тобто зменшення ступеня дисоціації. Таким чином, додавання до розчину слабкого електроліту однойменних іонів зменшує ступінь дисоціації. 21. Константа дисоціації. Закон розведення Оствальду. Теорія розчинів сильних електролітів Кількісно електролітичну дисоціацію як рівноважний оборотний процес можна охарактеризувати константою дисоціації (іонізації), яка визначається законом мас, що діють. Закон мас, що діють, строго кажучи, застосуємо до оборотних реакцій, тобто до розчинів слабких електролітів. Так, наприклад, дисоціацію електроліту KtnAnm можна подати у вигляді рівноважного процесу: Ktn Anm × nKtm+ + mAn . Відповідно до закону діючих мас константу рівноваги записують так: КД = (Ktm+)n+(Ann)m + (KtnAnm) де (Ktm+) та (Ann ) - молярні рівноважні концентрації іонів електроліту; (KtnAnm) - молярна рівноважна концентрація недисоційованих молекул електроліту; КД - Константа рівноваги, яка називається константою дисоціації. Це рівняння справедливе лише розбавлених розчинів слабких електролітів. При застосуванні його до концентрованих розчинів і розчинів сильних електролітів рівняння потрібно видозмінити. Чим більше константа дисоціаціїД тим сильніше дисоціює електроліт. На відміну від ступеня дисоціації КД залежить тільки від природи розчинника, електроліту та температури, але не залежить від концентрації розчину. Таким чином, і константа, і ступінь електролітичної дисоціації – кількісні характеристики дисоціації. Звичайно, між ними існує зв'язок. Багатоосновні кислоти та багатокислотні основи дисоціюють східчасто. Наприклад, дисоціація фосфорної кислоти відбувається у три ступені:  Аналогічно для багатокислотних основ (наприклад, Са(ОН))2) - дисоціація проходить у два щаблі. Ступінчаста дисоціація характеризується тим, що розпад електроліту на кожному наступному ступені відбувається меншою мірою, ніж на попередній. Такий характер зміни констант дисоціації можна пояснити електростатичним тяжінням з урахуванням закону Кулона. Енергія іонізації мінімальна, коли іон відривається від нейтральної молекули електроліту. Відрив іона кожному наступному щаблі дисоціації вимагає зростаючої енергії, оскільки видалення іона походить від частки, заряд якої наступних щаблях стає більше. Практично повна дисоціація сильних електролітів на іони незалежно від концентрації їх розчинів підтверджується фізичними та фізикохімічними методами дослідження. Так, значення теплоти нейтралізації всіх сильних кислот сильними основами розведених розчинах практично однакові. Незалежно від природи кислоти та основи набувають однакового значення АН = 56,5 кДж/моль. Цей факт - наочний доказ повної дисоціації розбавлених розчинів кислот та основ. У всіх випадках загальним процесом, що протікає при нейтралізації, є з'єднання іонів у молі 22. Теорія кислот та основ Багато електролітів, зокрема гідроксиди різних елементів Е, виявляють властивості кислот або основ. Дисоціація гідроксиду ЕОН може протікати за двома типами: 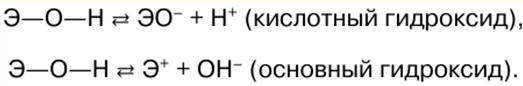 Розрив може відбуватися з обох зв'язків групи Е-О-Н. Як відомо, полярність і міцність зв'язків залежать від різниці електронегативності елементів, розміру та ефективного заряду атомів. Якщо енергія розриву зв'язку О-Н значно менша за енергію розриву зв'язку Е-О, то дисоціація гідроксиду протікає за кислотним типом. Якщо ж, навпаки, енергія розриву зв'язку О-Н значно більша за енергію розриву зв'язку Е-О, то дисоціація протікає за основним типом. У гідроксидах лужних і лужноземельних металів, а також перехідних металів у низьких ступенях окислення міцність зв'язку Е-О відносно мала, кисень більш міцно пов'язаний з воднем, і дисоціація Е-О-Н йде переважно за основним типом, тобто з відщепленням гідроксидіону . Це пов'язано з тим, що іони таких елементів мають досить великі розміри і малий ефективний заряд, тобто вони мають слабку поляризуючу здатність. Зі зростанням ступеня окислення збільшується поляризуюча дія атома Е (збільшення питомого заряду), кисень більш міцно пов'язаний з елементом Е, і дисоціація Е-О-Н протікає переважно за кислотним типом, тобто відщеплюється водень. Останнє пов'язане з перерозподілом електрон22бної щільності у атома кисню. В результаті зв'язок Е-О стає міцнішим, а зв'язок О-Н - слабкішим. В даний час не існує однозначного визначення понять кислоти та основи, яке однаково можна було б використовувати для характеристики кислотноосновних взаємодій у будь-яких розчинниках. Для характеристики багатьох електролітів у водних розчинах і в даний час можна використовувати поняття кислоти, основи, дані Арреніусом: 1) кислотою називається електроліт, що дисоціює у розчинах з утворенням водородіонів Н; 2) основою називається електроліт, що дисоціює в розчинах з утворенням гідроксидіонів ВІН; 3) амфолітом (амфотерним гідроксидом) називається електроліт, що дисоціює у розчині з утворенням як водородіонів, так і гідроксидіонів. До амфолітів відносять гідроксиди цинку, алюмінію, хрому та інших амфотерних елементів, а також амінокислоти, білки, нуклеїнові кислоти. Застосування принципу Ле Шательє до ланцюжка кислотноосновних рівноваг показує, що зі збільшенням у системі концентрації гідроксидіонів ОН зростає ймовірність дисоціації за кислотним типом. Збільшення у системі концентрації водородіонів Н+ призводить до переважної дисоціації за основним типом. Це означає, що у кислому середовищі амфоліт виявляє основний, а лужному середовищі - кислотний характер. Наприклад, гідроксид цинку при взаємодії з кислотами поводиться як основа: Zn (OH)2 + 2HCI - ZnCI2 + 2Н2О, а при взаємодії з лугами – як кислота: Zn(ВІН)2+ 2NaOH → Na2[Zn(OH)4]. 23. Буферні системи крові. Плазма крові Велике значення буферні системи мають у підтримці кислотноосновної рівноваги організмів. Внутрішньоклітинні та позаклітинні рідини всіх живих організмів характеризуються постійним значенням рН, яке підтримується за допомогою буферних систем. Значення рН переважно внутрішньоклітинних рідин знаходиться в інтервалі від 6,8 до 7,8. Кислотноосновна рівновага КОрівноваги в крові людини забезпечується водневої карбонатної, фосфатної та білкової буферними системами. Нормальне значення рН плазми становить 7,40 ± 0 05. Цьому відповідає інтервал значень активної кислотності від 3,7 до 4,0х108 моль/л. Так як у крові присутні різні електроліти (HC03 , H2CO3 , Н2РВ4 , НРО42 ), білки, амінокислоти, це означає, що вони дисоціюють такою мірою, щоб активність а(Н+) знаходилася у зазначеному інтервалі. У зв'язку з тим, що вміст неорганічних та органічних речовин у плазмі та клітинах крові неоднаковий, доцільно розглянути ці складові крові окремо. плазма крові Водневакарбонатна буферна система НСО3 / Н2СО3 складається з вугільної кислоти Н2СО3 та пов'язаної основи НСО3 . Це найважливіша буферна система крові. Один з компонентів - вугільна кислота Н2СО3 - утворюється при взаємодії розчиненого в плазмі2 з водою: СО2(р) + N2Він н2СО3. де СО2(р) - Концентрація розчиненого СО2 . Константа рівноваги цієї реакції: К = [Н2СО3] / [ЗІ2] Між СО2 в альвеолах і водневим карбонатним буфером в плазмі крові, що протікає через капіляри легень, встановлюється ланцюжок рівноваг. Водневакарбонатна буферна система діє як ефективний фізіологічний буферний розчин поблизу рН7,4. При вступі до крові кислот - донорів Н+ рівновага в ланцюжку за принципом Ле Шательє зміщується вліво внаслідок того, що іони НСО3 зв'язують іони Н молекули Н2СО3 . При цьому концентрація Н2СО3 підвищується, а концентрація іонів НСЗ3 знижується. Підвищення концентрації Н2СО3 призводить до усунення рівноваги вліво, (принцип Ле Шательє). Це викликає розпад Н2СО3 та збільшення концентрації СО2 , Розчиненого в плазмі. В результаті зміщується рівновага вліво і підвищується тиск СО2 у легенях. Надлишок СО2 виводиться із організму. В результаті водневакарбонатна система крові швидко приходить в рівновагу з СO2 в альвеолах та ефективно забезпечує підтримку сталості рН плазми крові. 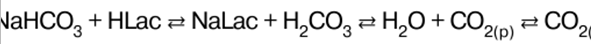 Таким чином, підтримується нормальне значення рН крові при слабо вираженому зсуві рН, зумовленому ацидозом. У замкнутих приміщеннях часто відчувають задуху (брак кисню), почастішання дихання. Однак ядуха пов'язана не стільки з недоліком кисню, скільки з надлишком СО2. Надлишок СO2 в атмосфері згідно із законом Генрі призводить до додаткового розчинення СO2 у крові. І це призводить до зниження рН крові, т. е. до ацидозу. Водневакарбонатна буферна система найбільш швидко відгукується на зміну рН крові. Її буферна ємність по кислоті становитьк = 40 ммоль/л плазми крові, а буферна ємність по лугу значно менше і дорівнює приблизнощ = 1-2 ммоль/л плазми. 24. Реакції нейтралізації Реакціями нейтралізації називаються обмінні реакції взаємодії кислот і основ, у яких утворюються сіль і вода. Розглянемо різні типи реакцій нейтралізації. 1. Нейтралізація сильної основи сильною кислотою: КІН + HNO3 - КНО3 + N2O. Молекулярно-іонне рівняння такої реакції Н+ + ОН → Н2O та негативне значення енергії Гіббса ΔG° показують, що рівновага практично зміщена у бік утворення води. Загальним випадком реакції нейтралізації є взаємодія кислот і основ, що різняться за силою (ступеня дисоціації). Ці реакції не доходять до кінця внаслідок перебігу зворотної реакції гідролізу солі. 2. Нейтралізація слабкої кислоти сильною основою:  або в молекулярноіонному вигляді:  У разі реакція нейтралізації оборотна. Зворотна та реакція нейтралізації слабкої основи сильною кислотою:  або в молекулярноіонному вигляді: 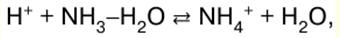 а також - слабкої основи слабкою кислотою: 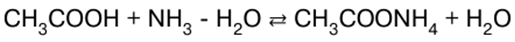 або в молекулярноіонному вигляді:  У цих системах рівновагу сильно зміщено вправо, оскільки вода значно слабший електроліт, ніж синильна кислота, аміак та оцтова кислота. Реакції нейтралізації є основою методу нейтралізації. Цей метод використовують у клінічних лабораторіях для визначення кислотності шлункового соку, буферної ємності плазми. У фармакології його застосовують для кількісного аналізу неорганічних кислот (соляної, сірчаної, борної) та органічних кислот (оцтової, бензойної, винної, лимонної, саліцилової). У біофармацевтичних дослідженнях методом нейтралізації визначають рКа кислот та рКь основ, оскільки за значенням цих величин можна прогнозувати здатність лікарських препаратів проходити через біологічні мембрани. Застосовують кислотноосновне титрування визначення рКа амінокислот та рКа дисоціюючих груп, що входять до білків. За кривими титрування білків, отриманих при двох різних температурах, можна визначити кількість карбоксильних, імідазольних та інших груп. Титрування амінокислот та білків дає можливість визначити їх ізоелектричні точки. Під гідролізом розуміють реакцію розкладання речовини водою. Гідроліз можуть піддаватися хімічні сполуки різних класів: білки, жири, вуглеводи, ефіри, солі і т. д. У неорганічній хімії найчастіше зустрічаються з гідролізом солей. 25. Гідроліз солі Гідроліз солі - це взаємодія солі з молекулами води, що призводить до утворення малодисоціювальних сполук. Процес гідролізу полягає в переході протону від молекули води до даного іону.32 + НОН * НСO3+ ВІН ) або від цього іону, у тому числі від гідратованого катіону металу, до молекули води. Залежно від природи солі вода виступає або як кислота, або як основа, а сіль є відповідно сполученою основою або сполученою кислотою. Можливі чотири варіанти гідролізу залежно від типу солі. 1. Солі, утворені сильною кислотою та слабкою основою:  2. Солі, утворені сильною основою та слабкою кислотою: CH3COONa + НОН → СН3СООН + NaOH. 3. Солі, утворені слабкою кислотою та слабкою основою. Ціанід амонію гідролізується за реакцією: 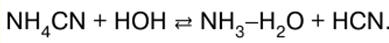 4. Солі, утворені сильною кислотою та сильною основою. NaCl, KNO3 гідролізу не піддаються. Механізм гідролізу солей полягає в поляризаційній взаємодії іонів солі з їх гідратною оболонкою. Чим сильніша ця взаємодія, тим інтенсивніше протікає гідроліз. Всі розглянуті випадки гідролізу стосувалися солей, утворених однокислотними основами та однією основними кислотами. Солі багатоосновних кислот та багатокислотних основ гідролізуються східчасто, утворюючи при цьому кислі та основні солі. Кількісно гідроліз як КОравновесие характеризується ступенем гідролізу та константою гідролізу. Ступінь гідролізу вимірюється відношенням кількості гідролізованої речовини до загальної кількості розчиненої речовини. Ступінь гідролізу залежить від природи солі, її концентрації та температури. Відповідно до закону діючих мас ступінь гідролізу зростає з розведенням розчину. Так, при концентрації Na2CO3 0,001 моль/л ступінь гідролізу становить 34%. У випадку справедливі такі закономірності. 1. Гідроліз солі повинен посилюватися з підвищенням температури та розведенням розчину. 2. При оборотному гідролізі відповідно до принципу Ле Шательє процес повинен пригнічуватися при підкисленні (якщо ця сіль утворена сильною кислотою і слабкою основою, накопичуються іони Н) або при підлужуванні (якщо сіль утворена слабкою кислотою та сильною основою, накопичуються іони ВІН). 3. Гідроліз солей, в результаті якого утворюються малорозчинні або газоподібні продукти, що видаляються зі сфери реакції (принцип зміщення рівноваги), необоротний. Наприклад, гідроліз Pb(SO4)2 протікає повністю внаслідок утворення осаду PbO2: Pb(SO4)2 + 2Н2O → PbO2 + 2H2SO4. Гідроліз характерний для багатьох класів неорганічних та органічних сполук. Гідроліз неорганічних сполук важливий з метою оцінки їх токсичності. Гідроліз органічних сполук застосовують для отримання цінних продуктів із деревини, жирів, ефірів та іншого, але особливо важливу роль гідроліз грає у життєдіяльності живих організмів. 26. Реакція осадження та розчинення До обмінних реакцій, що протікають у розчині електролітів, відносяться реакції осадження та розчинення. Реакції осадження супроводжуються випаданням опадів. Реакції, що супроводжуються розчиненням опадів, називаються реакціями розчинення. Широко використовують системи, що складаються з осаду електроліту важкорозчинного і насиченого розчину над ним. У таких системах між насиченим розчином та осадом встановлюється динамічна рівновага. Внаслідок низької розчинності концентрація важкорозчинного електроліту в розчині дуже мала, тому вважатимуться, що у розчині він повністю дисоційований. Інакше кажучи, динамічна рівновага в насиченому розчині встановлюється між твердою фазою речовини і іонами, що перейшли в розчин. Наприклад, у насиченому розчині AgCl має місце рівновага: AgCl(T) → Ag+(Р) + Cl(р). Концентрація твердої фази AgCl як величина постійна виразу для константи рівноваги виключається. Внаслідок цього константа рівноваги визначається лише добутком концентрацій іонів у розчині і називається константою або добутком розчинності. У загальному випадку для електроліту Ktn Anm константа розчинності визначається стехіометричним добутком концентрацій іонів: Кпр= [Ktm+ ]n[Ann]m Ця величина характеризує розчинність електроліту при постійній температурі без сторонніх речовин. Постійність Допр не означає сталості концентрацій окремих іонів у розчині. Так, можна збільшити концентрацію іонів Ag у насиченому розчині AgCl, додавши, наприклад, AgNO3 При цьому рівновага за принципом Ле Шательє зміститься вліво, що призведе до збільшення швидкості осадження іонів. Через деякий час швидкості розчинення AgCl та осадження іонів Ag та Cl зрівняються. Знову встановлена рівновага буде, як і раніше, характеризуватися величиною Кпр(AgCl), але рівноважні концентрації іонів Ag та Cl зміняться. Таким чином, на основі Допр можна прогнозувати утворення та розчинення опадів електролітів на основі двох правил. 1. Електроліт випадає в осад, коли стехіометричний добуток концентрацій його іонів у розчині більший за константу розчинності. 2. Осад електроліту розчиняється, коли стехіометричний добуток концентрацій складових його іонів у розчині стає меншим за константу розчинності. Реакції осадження лежать основою методу осадження, що застосовується у кількісному аналізі фармацевтичних препаратів. Метод осадження використовується у клінічному аналізі хлоридів у сечі, шлунковому соку, крові, у санітарногігієнічній практиці – при аналізі питної води. Вчені вважають, що різна розчинність природних сполук елементів у воді дуже вплинула на їх вміст у живих організмах. Між розчинністю сполук у воді та токсичною дією іонів ряду елементів є тісний взаємозв'язок. Наприклад, введення Al3 + в організм внаслідок утворення малорозчинного фосфату алюмінію AlPO4 27. Окисно-відновні реакції Одним із основних понять неорганічної хімії є поняття про ступінь окислення (СО). Ступенем окислення елемента у поєднанні називається формальний заряд атома елемента, обчислений з припущення, що валентні електрони переходять до атомів з більшою відносною електронегативністю (ОЕО) і всі зв'язки в молекулі сполуки є іонними. Ступінь окислення елемента Е вказують угорі над символом елемента зі знаком "+" або "-" перед цифрою. Ступінь окислення іонів, що реально існують у розчині або кристалах, збігається з їх зарядовим числом і позначається аналогічно зі знаком "+" або "-" після цифри, наприклад Cl,Са2+. Застосовують також метод Штока позначення ступеня окиснення римськими цифрами після символу елемента: Mn(VII), Fe(III). Питання знаку ступеня окислення атомів у молекулі вирішується виходячи з зіставлення електронегативностей пов'язаних між собою атомів, які утворюють молекулу. При цьому атом із меншою електронегативністю має позитивний ступінь окислення, а з більшою електронегативністю - негативний. Слід зазначити, що не можна ототожнювати рівень окислення з валентністю елемента. Валентність, яка визначається як число хімічних зв'язків, якими даний атом з'єднаний з іншими атомами, не може дорівнювати нулю і не має знака "+" або "-". Ступінь окислення може мати як позитивне, так і негативне значення, а також набувати нульового і навіть дробового значення. Так, у молекулі СO2 ступінь окислення С дорівнює +4, а в молекулі СН4 ступінь окислення С дорівнює 4. Валентність ж углерод4 а і в тому, і в іншому з'єднанні дорівнює IV. Незважаючи на зазначені вище недоліки, використання поняття ступеня окиснення зручно при класифікації хімічних сполук та складанні рівнянь окислювально-відновних реакцій. При окисленні елемента ступінь окислення збільшується, інакше кажучи, відновник під час реакції підвищує ступінь окислення. Навпаки, при відновленні елемента ступінь окиснення знижується, тобто при реакції окисник зменшує ступінь окиснення. Таким чином, можна дати і таке формулювання окислювально-відновних реакцій: окислювально-відновними реакціями називаються реакції, що протікають зі зміною ступеня окислення атомів елементів, що входять до складу реагуючих речовин. 28. Окислювачі та відновники Для прогнозу продуктів та напрями окислювально-відновних реакцій корисно пам'ятати, що типовими окислювачами є прості речовини, атоми яких мають велику ОЕО > 3,0 (елементи VIA та VIIA груп). З них найбільш сильні окислювачі фтор (ОЕО = 4,0), кисень (ОЕО = 3,0), хлор (ОЕО = 3,5). До важливих окислювачів відносяться PbO2 , КНО4 , Cа(SO4)2 , К2Сr2O7 , HClO, HClO3, КСІО4, NaBiO3, H2SO4(Конц), H.N.O.3(конц) , Na2O2 , (NH4)2S2O8 , КСІО3 , H2O2 та інші речовини, які містять атоми з вищою або високою СО. До типових відновників відносяться прості речовини, атоми яких мають малу ОЕО < 1,5 (метали IA та IIA груп та деякі інші метали). До важливих відновників відносяться H2S, NH3, HI, KI, SnCl2 , FeSO4 , C, H2 , CO, H2SO3 , Cr2(ТОМУ4)3 , CuCl, Na2S2O3 та інші речовини, що містять атоми з низькими СО. Речовини, що містять атоми в максимальному і мінімальному ступенях окислення, можуть бути відповідно тільки окислювачами, наприклад,2SG2O7 , КМпO4 , PbO2 , HClO4 або лише відновниками, наприклад NH3 , H2S, HI. Речовини, що містять атоми в проміжних ступенях окислення, здатні як підвищувати, так і знижувати ступінь окислення, тобто можуть бути як відновниками (при дії активнішого, ніж вони, окислювача), так і окислювачами (при дії більш активного, ніж вони , відновника). Такі речовини виявляють окислювально-відновну двоїстість. При складанні рівнянь окислювально-відновних реакцій можна застосовувати два методи: метод електронного балансу та іонноелектронний метод (метод напівреакцій). Більш правильне уявлення про окислювально-відновні процеси в розчинах дає іонноелектронний метод. За допомогою цього методу прогнозують зміни, які зазнають реально існуючих у розчині іони та молекули. Крім прогнозування продуктів реакції, іонні рівняння напівреакцій необхідні розуміння окислювально-відновних процесів, які протікають при електролізі й у гальванічних елементах. Цей метод відбиває роль середовища як учасника процесу. І нарешті, при використанні цього методу необов'язково заздалегідь знати всі речовини, що утворюються, так як багато з них виходять при складанні рівняння окислювально-відновних реакцій. Слід мати на увазі, що хоча напівреакції відображають реальні процеси, що йдуть при окислювально-відновних реакціях, їх не можна ототожнювати з реальними стадіями (механізмом) окислювально-відновних реакцій. На характер та напрямок окислювально-відновних реакцій впливають багато чинників: природа реагуючих речовин, реакція середовища, концентрація, температура, каталізатори. Слід мати на увазі, що негативне значення не завжди призводить до однозначного рішення про реальне перебіг реакції в даному напрямку, так як додатково необхідно враховувати кінетичний фактор. 29. Біологічне значення окисно-відновних процесів Окисно-відновними реакціями називаються хімічні процеси, що супроводжуються перенесенням електронів від одних молекул або іонів до інших. При окислювально-відновних реакціях протікають два взаємопов'язані процеси: окислення та відновлення. Окисленням називається процес втрати електронів. Відновленням – процес приєднання електронів. Речовини, атоми чи іони яких віддають електрони, називаються відновниками. Речовини, атоми чи іони яких приєднують електрони (або відтягують себе загальну пару електронів), називаються окислювачами. В реакції цинку з CuSO4 Cu2 + приєднують електрони: самі2+ + 2е־ - Сі0 . Атоми цинку віддають електрони: Zn0 - Zn2 + 2e־. Відповідно, CuSO4 - окислювач, Zn – відновник. Важливими процесами у тваринних організмах є реакції ферментативного окислення речовин субстратів: вуглеводів, жирів, амінокислот. В результаті цих процесів організми одержують велику кількість енергії. Приблизно 90% всієї потреби дорослого чоловіка енергії покривається за рахунок енергії, що виробляється в тканинах при окисленні вуглеводів і жирів. Решту енергії - ~10% дає окислювальне розщеплення амінокислот. Біологічне окислення протікає за складними механізмами за участю великої кількості ферментів. У мітохондріях окислення відбувається внаслідок перенесення електронів від органічних субстратів. Як переносники електронів в дихальний ланцюг мітохондрій входять різні білки, що містять різноманітні функціональні групи, які призначені для перенесення електронів. У міру просування ланцюгом від одного інтермедіату до іншого електрони втрачають вільну енергію. На кожну пару електронів, переданих дихальним ланцюгом кисню, синтезуються 3 молекули АТФ. Вільна енергія, що вивільняється при перенесенні 2 електронів на кисень, становить 220 кДж/моль. На синтез 1 молекули АТФ у стандартних умовах витрачається 30,5 кДж. Звідси ясно, що досить значна частина вільної енергії, що виділяється при перенесенні однієї пари електронів, запасається в молекулах АТФ. З цих даних стає зрозумілою роль багатостадійної передачі електронів від вихідного відновника до кисню. Велика енергія (220 кДж), що виділяється при перенесенні однієї пари електронів до кисню, розбивається ряд порцій, відповідних окремим стадіям окислення. На трьох таких стадіях кількість енергії, що виділяється, приблизно відповідає енергії, необхідної для синтезу 1 молекули АТФ. Окисно-відновні реакції лежать в основі методів оксидиметрії, які застосовуються в клінічному аналізі для визначення в крові іонів Са, сечової кислоти, ферментів каталази та пероксидази, цукру, а в санітарно-гігієнічному - для визначення окислюваності води, вмісту активного хлору в хлорному вапні, залишкового хлору в господарствах воді 30. Хімічний зв'язок та її експериментальні характеристики Розробка сучасної моделі атома та передбачення на її основі властивостей індивідуальних атомів – дуже важливе досягнення квантової механіки. Однак у земних умовах рідко зустрічаються ізольовані атоми. Навколишні тіла неживої і живої природи складаються з різноманітних молекул. А. М. Бутлеров (1828-1886) створив теорію хімічної будови органічних речовин (1861). З цього часу в хімію починають поступово входити поняття "валентність" та "хімічний зв'язок". Валентністю називається здатність атома приєднувати кілька інших атомів з утворенням молекули. Валентність позначається рисками у символу елемента. Водень (Н) – одновалентний, кисень (0=) – двовалентний. Число валентних рис визначає число хімічних зв'язків, які даний атом може утворювати з іншими атомами. Хімічною зв'язком називається сукупність взаємодій між електронами та ядрами, що призводять до з'єднання атомів у молекулу. Властивості хімічного зв'язку вивчають у різний спосіб. За допомогою хімічних методів визначають кількість зв'язків атомів (валентність) та їхню реакційну здатність. За допомогою фізичних методів визначають довжину, міцність, орієнтацію та полярність хімічних зв'язків. Довжиною хімічного зв'язкус називається величина, що вимірюється відстанню між ядрами зв'язуваних атомів. Як одиниця виміру довжини хімічного зв'язкус зручно використовувати пікометр (пм): 1 пм = 1012 м. Міцність хімічного зв'язку Ес - величина, що вимірюється ентальпією ΔЕс освіти зв'язку. Як одиниця виміру міцності хімічного зв'язку Ес використовується кДж/моль. Орієнтація хімічного зв'язкус - величина, що вимірюється кутом між напрямками зв'язків даного атома з сусідніми атомами молекули. Кут ас називається валентним. Одиниця виміру валентного кутас - градус. Полярність хімічного зв'язкус - Величина, що вимірюється електричним моментом даного зв'язку. Електричний момент для двох електричних зарядів +q і ־q, рівних за абсолютним значенням і протилежних за знаком, дорівнює μ = qr, де r - відстань між зарядами. Такі два заряди утворюють електричний диполь. Хімічний зв'язок поляризується, коли зв'язуються 2 атоми з різною електронегативністю (ОЕО). У результаті атомі з великим значенням ОЭО виникає надлишковий негативний заряд δ, але в іншому атомі з меншим значенням ОЭО - надлишковий позитивний заряд +δ. Полярність зв'язку розраховується за такою формулою: μс = δrс. Як одиниця виміру полярності хімічного зв'язку зручно використовувати позасистемну одиницю Дебай (D) - 1 D = 3,3 х 1030 Кл/м. Полярність О-Н зв'язку в молекулі води дорівнює μвін = 1,5 D. Вивчення хімічного зв'язку показало, що здебільшого довжина, міцність, орієнтація, полярність однієї й тієї ж хімічної зв'язку у різних сполуках мають приблизно однакові значення. Звідси випливає, що взаємодії, що призводять до утворення зв'язку між атомами, мають однакову природу в різних молекулах. Квантовомеханічні теорії хімічного зв'язку дають пояснення цьому факту. 31. Водневий зв'язок. Міжмолекулярний та внутрішньомолекулярний водневий зв'язок Хімічні зв'язки в молекулах зазвичай дуже міцні, їхня енергія знаходиться в межах 100-150 кДж/моль. Крім цього, існують звані водневі зв'язки, міцність яких становить 10-40 кДж/моль. Довжина цих зв'язків відповідно 270-230 пм. Водневим зв'язком між атомами ЕА та ЕВ називається взаємодія, що здійснюється атомом водню, з'єднаним з ЕА або ЕВ хімічним зв'язком. Зображення водневого зв'язку в загальному випадку має вигляд: ЭА-Н ...Ев.. Очевидно, що водневий зв'язок трицентровий, тому що в її освіті беруть участь 3 атоми. Для виникнення такого зв'язку необхідно, щоб атоми ЕА та ЕВ мали велику електронегативність. Це атоми найбільш негативних елементів: азоту (ОЕО = 3,0), кисню (ОЕО = 3,5), фтору (ОЕО = 4,0) та хлору (ОЕО = 3,0). Водневий зв'язок утворюється в результаті комбінації ls-AO водню та двох 2рАО атомів ЕА та ЕВ; 2рорбіталі орієнтовані вздовж однієї прямої. Тому водневий зв'язок лінійний. Водневий зв'язок називається: 1) внутрішньомолекулярної, якщо атоми ЕА та ЕВ , Сполучені цим зв'язком, належать одній і тій же молекулі; 2) міжмолекулярною, якщо атоми ЕА та ЕВ перебувають у різних молекулах. Внутрішньомолекулярні водневі зв'язки відіграють найважливішу біологічну роль, оскільки визначають, наприклад, спіральну структуру полімерних молекул білків. У білках це зв'язку N-Н ... Про між амінокислотними залишками. Не менш важливими є міжмолекулярні водневі зв'язки. З їхньою допомогою з'єднані ланцюги нуклеїнових кислот, що утворюють подвійну спіраль. Тут є два типи зв'язків між нуклеїновими основами - NHN та N-Н-О. Середня кінетична енергія теплового руху молекул має значення 3/2RT. При температурі людського тіла 37 ° С (310 ° К) це становить близько 4 кДж/моль. Міцність водневих зв'язків знаходиться в межах 10-40 кДж/моль, тому вони досить міцні, щоб витримувати постійні удари навколишніх молекул та забезпечувати сталість форми полімерних біологічних структур. Разом з тим, при ударах активних молекул водневі зв'язки періодично розриваються, потім знову відновлюються, забезпечуючи перебіг різних процесів життєдіяльності. Розглянуті приклади наочно ілюструють ширше коло застосування методу МО ЛКАО, ніж методу НД. Проте метод ЗС може успішно використовуватися для прогнозування властивостей та будови багатьох речовин, у тому числі комплексних сполук. 32. Макро та мікроелементи в середовищі та в організмі людини Існують різні класифікації хімічних елементів, які у організмі людини. Так, В. І. Вернадський залежно від середнього змісту (масової частки w, %) у живих організмах поділяв елементи за декадною системою. Відповідно до цієї класифікації елементи, що містяться в живих організмах, ділять на три групи: макро, мікро та ультрамікроелементи. макроелементи Це елементи, вміст яких в організмі вищий за 102%. До них відносяться кисень, вуглець, водень, азот, фосфор, сірка, кальцій, магній, натрій та хлор. мікроелементи Це елементи, вміст яких в організмі знаходиться в межах 103 до 105%. До них належать йод, мідь, миш'як, фтор, бром, стронцій, барій, кобальт. ультрамікроелементи Це елементи, вміст яких в організмі нижче 105%. До них належать ртуть, золото, уран, торій, радій та ін. В даний час ультрамікроелементи поєднують з мікроелементами в одну групу. Ця класифікація відбиває лише вміст елементів у живих організмах, але з вказує на біологічну роль і фізіологічне значення тієї чи іншої елемента. В. В. Ковальський, виходячи із значущості для життєдіяльності, підрозділив хімічні елементи на три групи. Життєво необхідні (незамінні) елементи Вони постійно містяться в організмі людини, входять до складу ферментів, гормонів та вітамінів: Н, О, Са, N, К, Р, Na, S, Mg, d, C, I, Mn, Cu, Co, Fe, Zn, Mo, V. Їхній дефіцит призводить до порушення нормальної життєдіяльності людини. Домішні елементи Ці елементи постійно містяться в організмі тварин і людини: Ga, Sb, Sr, Br, F, B, Li, Si, Sn, Cs, Al, Ba, Ge, As, Rb, Pb, Ra, Bi, Cd, Cr, Ni, Ti, Ag, Th, Hg, U, Se. Біологічна роль їх мало з'ясована чи невідома. Домішні елементи Sc, Tl, In, La, Pr, Sm, W, Re, Tb та ін. Виявлено в організмі людини та тварин. Дані про кількість та біологічну роль поки не з'ясовано. Елементи, необхідні для побудови та життєдіяльності різних клітин та організмів, називаються біогенними елементами. Точно перерахувати всі біогенні елементи в даний час ще неможливо через складність визначення дуже низьких концентрацій мікроелементів та встановлення їх біологічних функцій. Для 24 елементів біогенність встановлена надійно. Це елементи першої та деякі елементи другої груп (за Ковальським). 33. Топографія найважливіших біогенних елементів в організмі людини Органи людини по-різному концентрують у собі різні хімічні елементи, тобто мікро та макроелементи нерівномірно розподіляються між різними органами та тканинами. Більшість мікроелементів накопичується в печінці, кістковій та м'язовій тканинах. Ці тканини є основними депо (запасниками) багатьом мікроелементів. Елементи можуть виявляти специфічну спорідненість по відношенню до деяких органів і утримуватись у них у високих концентраціях. Добре відомо, що цинк концентрується в підшлунковій залозі, йод - в щитовидній, фтор - в емалі зубів, алюміній, миш'як, ванадій накопичуються у волоссі та нігтях, кадмій, ртуть, молібден - у нирках, олово - у тканинах кишечника, передміхурової залози, кісткової тканини, барій - у пігментній сітківці ока, бром, марганець, хром - у гіпофізі тощо. В організмах мікроелементи можуть перебувати у зв'язаному стані та у вигляді вільних іонних форм. Відомо, що кремній, алюміній, мідь і титан у тканинах мозку знаходяться у вигляді комплексів з білками, тоді як марганець - в іонному вигляді. Водень та кисень – макроелементи. Вони входять до складу води, якою в організмі дорослої людини в середньому міститься близько 65%. Вода нерівномірно розподілена по органам, тканинам та біологічним рідинам людини. Так, у шлунковому соку, слині, плазмі крові, лімфі вода становить від 89,5 до 90%, у сечі, сірій речовині головного мозку, нирках – 80%, у білій речовині головного мозку, печінці, шкірі, спинному мозку, м'язах, легенів, серце – 70-80%. Найменше - 40% води - міститься у скелеті. Макроелементи – вуглець, водень, кисень, азот, сірка, фосфор – входять до складу білків, нуклеїнових кислот та інших біологічно активних сполук організму. Вміст вуглецю в білках становить 51-55%, кисню - 22-24%, азоту - 15-18%, водню - 6,5-7%, сірки - 0,3-2,5%, фосфору - близько 0,5 %. Вуглець, водень та кисень входять також до складу вуглеводів, вміст яких у тканинах тварин невеликий - приблизно 2%. Ці елементи входять до складу ліпідів (жирів). Крім того, до складу фосфоліпідів входить фосфор як фосфатних груп. Найбільшою мірою ліпіди концентруються в головному мозку (12%), потім у печінці (5%), молоці (2-3%) та сироватці крові (0,6%). Однак основна частина фосфору (600 г) міститься у кістковій тканині. Це становить 85% від маси всього фосфору, що у організмі людини. Концентрується фосфор і в твердих тканинах зубів, до складу яких він входить разом з кальцієм, хлором, фтором у вигляді гідроксилу, хлору, фторапатиту загальної формули Са5 (РО4)3Х де X = ВІН, CI, F відповідно. Кальцій переважно концентрується в кістковій, а також у зубній тканинах. Натрій та хлор в основному містяться у позаклітинних рідинах, а калій та магній – у внутрішньоклітинних. У вигляді фторидів натрій і калій входять до складу кісткової та зубної тканин. Магній у вигляді фосфату Mg3 (PO4)2 міститься у твердих тканинах зуба. У підтримці певного вмісту макро мікроелементів в організмі беруть участь гормони. 34. Біологічна роль хімічних елементів у організмі Біологічна роль хімічних елементів у людини надзвичайно різноманітна. Головна функція макроелементів полягає у побудові тканин, підтримці сталості осмотичного тиску, іонного та кислотноосновного складу. Мікроелементи, входячи до складу ферментів, гормонів, вітамінів, біологічно активних речовин як комплексоутворювачі або активатори, беруть участь в обміні речовин, процесах розмноження, тканинному диханні, знешкодженні токсичних речовин. Мікроелементи активно впливають на процеси кровотворення, окислення, відновлення, проникність судин та тканин. Макро та мікроелементи – кальцій, фосфор, фтор, йод, алюміній, кремній – визначають формування кісткової та зубної тканин. Виявлено чимало захворювань, пов'язаних із нестачею чи надмірним накопиченням різних мікроелементів. Дефіцит фтору викликає карієс зубів, дефіцит йоду – ендемічний зоб, надлишок молібдену – ендемічну подагру. Такі закономірності пов'язані з тим, що у людини підтримується баланс оптимальних концентрацій біогенних елементів - хімічний гомеостаз. Порушення цього балансу внаслідок нестачі або надлишку елемента може призводити до різних захворювань. Крім шести основних макроелементів - органогенів (вуглецю, водню, азоту, кисню, сірки та фосфору), з яких складаються вуглеводи, жири, білки та нуклеїнові кислоти, для нормального харчування людини та тварин необхідні неорганічні макроелементи - кальцій, хлор, магній, калій, натрій – та мікроелементи – мідь, фтор, йод, залізо, молібден, цинк, а також, можливо (для тварин доведено), – селен, миш'як, хром, нікель, кремній, олово, ванадій. Аналіз вмісту та співвідношення мікроелементів в організмі людини знаходить застосування і в судово-медичній експертизі. Наприклад, у разі алкогольного отруєння під впливом етилового спирту в печінці підвищується вміст кальцію, а натрію та калію стає менше. При цьому в серці та нирках, навпаки, вміст кальцію знижується. Недолік у харчовому раціоні таких елементів, як залізо, мідь, фтор, цинк, йод, кальцій, фосфор, магній та інших, призводить до серйозних наслідків для здоров'я людини. Однак необхідно пам'ятати, що для організму шкідливий не лише недолік, а й надлишок біогенних елементів, оскільки при цьому порушується хімічний гомеостаз. Мінеральні компоненти, які в мізерно малих кількостях є життєво необхідними, при більш високих концентраціях стають токсичними. Ряд елементів (срібло, ртуть, свинець, кадмій та інших.) вважаються токсичними, оскільки потрапляння в організм навіть у мікрокількостях призводить до важких патологічних явищ. Широко використовуються різні елементи та їх сполуки як лікарські засоби. Таким чином, вивчення біологічної ролі хімічних елементів, з'ясування взаємозв'язку обміну цих елементів та інших біологічно активних речовин (ферментів, гормонів, вітамінів) сприяє створенню нових лікарських препаратів та розробці оптимальних режимів їх дозування як з лікувальною, так і з профілактичною метою. 35. S-елементи та їх з'єднання Вода - одне з найважливіших і поширених Землі сполук водню. Водний простір займає майже 75% поверхні земної кулі. В організмі дорослої людини в середньому міститься 65-67% води, у плода (4місячних) – 94%, у новонароджених – 74%. Всі хімічні реакції в організмі протікають лише у водному середовищі. Життя без води неможливе. Дистильована вода – фармакопейний препарат. У медичній практиці знаходить застосування ще одна сполука водню - пероксид водню Н2. Це є важливим побічним продуктом метаболізму. Пероксид водню – безбарвна, прозора рідина. При попаданні на шкіру та слизові оболонки викликає печіння. Молекула Н2О2 полярна. Наявність неподілених пар електронів у атомів кисню уможливлює утворення донорноакцепторних зв'язків пероксиду водню з лігандами - акцепторами електронів. Ступінь окислення кисню в Н2О2 дорівнює 1, тобто має проміжне значення між ступенем окислення кисню у воді (2) і в елементному кисні2 . З цього випливає, що пероксид водню може виявляти як властивості окислювача, так і властивості відновника (окислювально-відновна двоїстість). Однак, судячи з стандартних окислювально-відновних потенціалів напівреакцій, для пероксиду водню більш характерні окисні властивості. Чистий пероксид водню термодинамічно нестабільний і при стоянні розкладається із вибухом на воду та кисень із виділенням великої кількості теплоти. Водні розчини пероксиду водню більш стійкі, у прохолодному місці можуть зберігатися тривалий час. У продаж пероксид водню зазвичай надходить у вигляді 30% водного розчину - пергідролю. Співпроцес розкладання пероксиду водню значно прискорюється у присутності солей важких металів. Розпад пероксиду водню, що каталізується іоном металу, може призводити до утворення радикалів, найбільш важливими з яких є гідроксидний АЛЕ і гідропероксидний. Токсичність пов'язана з тим, що Н2О2 і О2 взаємодіють з ліпідним шаром клітинних мембран та ушкоджують їх. У медичній практиці пероксид водню застосовують переважно як зовнішній бактерицидний засіб. Дія Н2О2 засноване на окислювальній здатності пероксид водню та нешкідливості продукту його відновлення – води. При обробці ран кисень, що виділяється, грає подвійну роль: 1) має протимікробну, дезодоруючу та депігментуючу дію, вбиваючи мікробні тіла; 2) утворює піну, сприяючи переходу частинок тканинного розпаду у зважений стан та очищення ран. Як фармакопейний препарат використовується 3% водний розчин пероксид водню, 6% розчин пероксиду водню застосовується для знебарвлення волосся. У вигляді 30% розчину пероксид водню застосовується при лікуванні бородавчастої форми червоного плоского лишаю і для видалення юнацьких бородавок. 36. Біологічна роль s-елементів ІА-групи (літій, рубідій, цезій, францій) За вмістом в організмі людини натрій (0,08%) та калій (0,23%) відносяться до макроелементів, а решта лужних металів - літій (104%), рубідій (105%), цезій (104%) – до мікроелементів. літій Вміст літію в людини близько 70 мг (10 ммоль) - 104%. З'єднання літію у вищих тварин концентруються у печінці, нирках, селезінці, легенях, крові, молоці. Максимальна кількість літію знайдено у м'язах людини. Біологічна роль літію як мікроелемента поки що до кінця не з'ясована. Доведено, що на рівні клітинних мембран іони Li (за достатньої концентрації) конкурують з іонами натрію при проникненні в клітини. Очевидно, заміщення іонів Na у клітинах іонами Li пов'язане з більшою ковалентністю сполук літію, внаслідок чого вони краще розчиняються у фосфоліпідах. Встановлено, що деякі сполуки літію позитивно впливають на хворих на маніакальну депресію. Всмоктуючи із шлунково-кишкового тракту, іони Li накопичуються в крові. Коли концентрація іонів Li досягає 0,6 ммоль/л і вище, відбувається зниження емоційної напруженості та ослаблення маніакального збудження. Водночас вміст іонів Li у плазмі крові слід суворо контролювати. У випадках, коли концентрація іонів Li перевищує 1,6 ммоль/л, можливі негативні явища. Рубідій та цезій За вмістом в організмі людини рубідій (105%) та цезій (104%) відносяться до мікроелементів. Вони завжди містяться в організмі, але біологічна роль їх ще не з'ясована. Як повний аналог калію, рубідій також накопичується у внутрішньоклітинній рідині і може в різних процесах замінювати еквівалентну кількість калію. Радіоактивні ізотопи 13rCs та 87Rb використовуються в радіотерапії злоякісних пухлин, а також щодо метаболізму калію. Завдяки швидкому розпаду їх можна навіть вводити в організм, не побоюючись тривалої шкідливої дії. Франція Це радіоактивний хімічний елемент, одержаний штучним шляхом. Є дані, що францій здатний вибірково накопичуватися в пухлинах на ранніх стадіях їх розвитку. Ці спостереження можуть бути корисними при діагностиці онкологічних захворювань. Таким чином, з елементів IA групи фізіологічно активні Li, Rb, Cs, a Na і К – життєво необхідні. Близькість фізикохімічних властивостей Li і Na, обумовлена схожістю електронної будови їх атомів, проявляється і в біологічній дії катіонів (накопичення позаклітинної рідини, взаємозамінність). Аналогічний характер біологічної дії катіонів елементів великих періодів.+, руб+, Cs+ (Накопичення у внутрішньоклітинній рідині, взаємозамінність) також обумовлений подібністю їх електронної будови та фізикохімічних властивостей. На цьому засноване застосування препаратів натрію та калію при отруєнні солями літію та рубідії. 37. Біологічна роль s-елементів ІА-групи (натрій, калій) Вміст натрію в людини масою 70 кг становить близько 60 р (2610 ммоль) - 0,08%. З цієї кількості 44% натрію знаходиться у позаклітинній рідині та 9% - у внутрішньоклітинній. Решта натрію знаходиться в кістковій тканині, що є місцем депонування іона Na в організмі. Близько 40% натрію, що міститься в кістковій тканині, бере участь в обмінних процесах, і завдяки цьому скелет або донором, або акцептором іонів Na, що сприяє підтримці сталості концентрації іонів Na в позаклітинній рідині. Натрій є основним позаклітинним іоном. В організмі людини натрій знаходиться у вигляді розчинних солей, головним чином - хлориду, фосфату і карбонату водню. Натрій розподілений по всьому організму: у сироватці крові, спинномозковій рідині, очній рідині, травних соках, жовчі, нирках, шкірі, кістковій тканині, легенях, мозку. Іони Na грають важливу роль у забезпеченні сталості внутрішнього середовища людського організму, беруть участь у підтримці постійного осмотичного тиску біорідини (осмотичного гомеостазу). Іони Na беруть участь у регуляції водного обміну та впливають на роботу ферментів. Разом з іонами K, Mg, Ca, Cl іон Na бере участь у передачі нервових імпульсів та підтримує нормальну збудливість м'язових клітин. При зміні вмісту натрію в організмі відбуваються порушення функцій нервової, серцево-судинної та інших систем, гладких та скелетних м'язів. Хлорид натрію NaCl є основним джерелом соляної кислоти для шлункового соку. В організм людини натрій надходить переважно у вигляді кухонної солі. Справжня щоденна потреба організму натрію становить 1 г, хоча середнє споживання цього елемента досягає 4-7 р. Безперервне надлишкове споживання NaCl сприяє появі гіпертонії. При дії лугів на мікробні клітини відбувається осадження клітинних білків і внаслідок цього – загибель мікроорганізмів. Сульфат натрію (глауберова сіль) Na2SO4 × 10H2O застосовують як проносний засіб. Тетраборат натрію Na2B4О7 × 10H2O застосовують зовнішньо як антисептичний засіб для полоскань, спринцювання, змащування. Гідроксид натрію у вигляді 10% розчину входить до складу силаміну, що застосовується в ортопедичній практиці для виливки вогнетривких моделей при виготовленні суцільнолитих протезів з кобальтохромового сплаву. Вміст калію в організмі людини масою 70 кг становить приблизно 160 г (4090 ммоль) – 0,23%. Калій є основним внутрішньоклітинним катіоном, становлячи 2/3 від загальної кількості активних клітинних катіонів. Із загальної кількості калію, що міститься в організмі, 98% знаходиться усередині клітин і лише близько 2% – у позаклітинній рідині. Калій поширений у всьому організмі. Його топографія: печінка, нирки, серце, кісткова тканина, м'язи, кров, мозок тощо. буд. Іони До є важливими активаторами ферментів, що усередині клітини. 38. Біологічна роль s-елементів ІІА-групи. Їх застосування у медицині (берилій, магній, кальцій) Берилій знаходиться у рослинах, а також в організмах тварин. Вміст берилію в живих організмах становить 107%, тобто він є домішковим ультрамікроелементом. Біологічна роль берилію вивчена недостатньо. Сполуки берилію токсичні та викликають ряд захворювань (бериллієвий рахіт, бериліоз тощо). Особливо токсичні леткі сполуки берилію. Негативний вплив Ве2+ на фізіологічні процеси пояснюється його хімічними властивостями. Магній формально відноситься до макроелементів. Загальний вміст його в організмі – 0,027% (близько 20 г). Топографія магнію в організмі людини така: найбільше магній концентрується в дентині та емалі зубів, кістковій тканині. Накопичується він також у підшлунковій залозі, скелетних м'язах, нирках, мозку, печінці та серці. У дорослої людини добова потреба в магнії становить близько 0,7 г. Іон Mg, як і іон K, є внутрішньоклітинним катіоном. У біологічних рідинах і тканинах організму магній знаходиться як у вигляді акваіону, так і у зв'язаному з білками стані у кількості < 102%, тобто, по суті це мікроелемент. Концентрація іонів Mg усередині клітин приблизно в 2,5-3 рази вища, ніж у позаклітинних рідинах. Іони магнію відіграють важливу біологічну роль організмі людини. Внаслідок меншого радіусу іона та більшої енергії іонізації Mg2+ утворює міцніші зв'язки, ніж іон Ca, і тому є активнішим каталізатором ферментативних процесів. Входячи до складу різних ферментативних систем, іон Mg є їх незамінним компонентом та активатором (такі ферменти, як карбоксипептидаза, холінестераза та деякі інші, є специфічними для іона Mg). Гідроліз АТФ, пов'язаний з рядом ферментативних реакцій, в результаті яких утворюється гідрофосфатіон НРО2 та виділяється велика кількість енергії, проходить при надлишку Mg2+. Кальцій відноситься до макроелементів. Загальний вміст його в організмі – 1,4%. Кальцій міститься у кожній клітині людського організму. Основна маса кальцію знаходиться в кістковій та зубній тканинах. В середньому доросла людина на добу повинна споживати 1 г кальцію, хоча потреба в кальції становить лише 0,5 г. Кальцій, що вводиться з їжею, лише на 50% всмоктується в кишечнику. Порівняно погане всмоктування є наслідком утворення в шлунково-кишковому тракті важкорозчинних фосфату кальцію Са3(РО4)2 та кальцієвих солей жирних кислот. В організмі концентрація іонів Са регулюється гормонами. У кістках та зубах дорослої людини близько 1 кг кальцію знаходиться у вигляді нерозчинного кристалічного мінералу – гідроксилапатиту Са10(РВ4)6(ОН)2 , утворення якого відбувається при взаємодії іонів Са з фосфатіонами У крові та лімфі кальцій знаходиться як в іонізованому, так і в неіонізованому стані – у сполуках з білками, вуглеводами та ін. Механізм згортання крові складається з низки етапів, що залежать від наявності іонізованого Са. Іони Са беруть участь у передачі нервових імпульсів, скороченні м'язів, регулюванні роботи серцевого м'яза. Концентрація іонів Са всередині та поза клітиною відповідно становить 106 та (2,25-2,8) 103 моль/л. Оскільки кальцій практично не використовується всередині клітини, він виступає як будівельний матеріал в організмі - в кістках, зубах. Скелет – основне сховище кальцію в організмі. 39. Біологічна роль d-елементів групи VIB. Їх застосування у медицині Хром виявляється в рослинних та тваринних організмах. В організмі дорослої людини міститься приблизно 6 г Сг (0,1%). Металевий хром нетоксичний, а сполуки Сг(III) та Cr(VI) небезпечні для здоров'я. Вони викликають подразнення шкіри, що призводить до дерматитів. Є припущення, що похідні хрому (VI) мають канцерогенні властивості. 0,25-0,3 г дихромату калію викликають летальний кінець. Сполуки хрому (VI) застосовуються як фунгіциди (що протруюють речовини, fungus - "гриб", caldere - "вбивати"). Сполуки хрому (III) сприятливо впливають зростання рослин. Молібден відноситься до "металів життя", будучи одним з найважливіших біоелементів. Його особливе становище було відзначено 20-25 років тому Ф. Кріном та Л. Орілом. Ці вчені висунули ідею, що виникнення життя на Землі відбувалося не еволюційним шляхом, а що воно було занесене невідомою цивілізацією з космосу з молібденових зірок, де життя існувало задовго до нас. У біохімічних процесах молібден бере участь у ступенях окиснення VіVI. У цих станах він створює стійкі оксоформи. Молібден утворює стійкі оксокомплекси і, мабуть, тому входить до складу ферментів, що забезпечують перенесення оксогруп. У крові переважає Mo(VI); якщо лігандом є кисень, то утворюються стійкі ізополімолібдатіони. Надмірний вміст молібдену в їжі порушує метаболізм Са2+ та РВ4 , викликаючи зниження міцності кісток – остеопорози. Можливо, відбувається зв'язування у фосфорномолібденові комплекси. Такі комплекси можна як кислотні залишки гетерополімолібденових кислот. З кальцієм ці залишки дають нерозчинні кристали. Не виключено, що ці кристали ініціюють відкладення солей сечової кислоти і викликають захворювання на подагру. Подагра деформує суглоби, виправдовуючи свій буквальний переклад – "капкан для ніг". Крім кисневих комплексів, молібден утворює галогенідні (Hal), тіоціанатні (NCS) та ціанідні (CN) комплекси. Молібден входить до складу різних ферментів. В організмі людини до них відносяться альдегідогідроксідази, ксантіндегідрогенази, ксантиноксидази. Молекулярна маса ксантиноксидази (КОКС) – 250 000 а. е. м. Це молібденсодержащий фермент ссавців. Він може каталізувати окислення ксантину та інших пуринів, а також альдегідів. Перетворення гіпоксантину та ксантину на сечову кислоту каталізується ксантиноксидазою. Передбачається, що в ході каталітичного процесу молібден утворює зв'язок із азотом та киснем ксантину. Молібден є найважливішим мікроелементом рослин, тому що біологічно активні речовини за його участю забезпечують м'яку фіксацію азоту: перетворюють його на аміак або азотовмісні продукти. Порівняно з іншими промислово важливими металами молібден малотоксичний. Споживання молібдену з продуктами харчування – 0,1 – 0,3 мг на добу, але необхідне денне надходження не встановлено. Дефіцит молібдену спричинює зменшення активності ксантиноксидази у тканинах. Надлишковий вміст молібдену спричиняє остеопорози. Вольфрам – мікроелемент. Його роль організмі вивчена недостатньо. Аніонна форма вольфраму легко абсорбується у шлунково-кишковому тракті. Металевий вольфрам та його катіонні форми не абсорбуються в організмі. Про гомеостаз вольфраму у ссавців немає. 40. Біологічна роль сполук марганцю. Їх застосування у медицині З елементів VIIB групи лише марганець є біогенним елементом і одним із десяти "металів життя", необхідних для нормального перебігу процесів у живих організмах. У тілі дорослої людини міститься 12 мг. Марганець концентрується у кістках (43%), решта – у м'яких тканинах, у тому числі й у мозку. В організмі марганець утворює металокомплекси з білками, нуклеїновими кислотами, АТФ, АДФ, окремими амінокислотами. Містять марганець металоферменти аргіназу, холінестеразу, фосфоглюкомутазу, піруваткарбоксилазу. Зв'язування аміаку – токсичного продукту перетворення амінокислот в організмі ссавців – здійснюється через амінокислоту аргінін. Аргіназа - фермент, що каталізує у печінці гідроліз аргініну. В результаті аргінін розщеплюється на сечовину та циклічну амінокислоту орнітин. Сечовина - нетоксична, розчинна у воді речовина. Воно потоком крові доставляється в нирки та виводиться із сечею. Атомний радіус марганцю 128 пм. Це пояснює та обставина, що марганець може заміняти магній (атомний радіус 160 пм) у його поєднанні з АТФ, суттєво впливаючи на перенесення енергії в організмі. Іони Mg та Mn здійснюють також активацію ферментів - нуклеаз. Ці ферменти каталізують у дванадцятипалій кишці гідроліз нуклеїнових кислот ДНК та РНК. В результаті ці біополімери розщеплюються на мономерні одиниці – нуклеотиди. Зокрема, такою нуклеазою є дезоксирибонуклеаза, яка каталізує гідроліз ДНК лише у присутності Mg2+ або Мп2+. Марганець може входити до складу неорганічних сполук організму. Це, наприклад, малорозчинний пірофосфат марганцюмагнію MnMgP2O7. Кристали цієї солі локалізуються на внутрішній поверхні мембрани везикул. Майже однакове значення атомного радіусу марганцю та заліза пояснює здатність марганцю заміщати залізо у порфіриновому комплексі еритроциту. З тієї ж причини марганець може заміщати і цинк у цинкзалежних ферментах, змінюючи їх каталітичні властивості. Перманганат калію КМПО4 - найбільш відома сполука марганцю, яка застосовується в медицині. Використовують водні розчини із вмістом КМпО4 0,01-5%. Як кровоспинний засіб застосовують 5%ний розчин. Розчини перманганату калію мають антисептичні властивості, які визначаються його високою окисною здатністю. З інших сполук марганцю слід відзначити сульфату марганцю (II) та хлорид марганцю (II), які використовують при лікуванні недокрів'я. Про наявність технеції в живих організмах даних немає. Однак сполуки технеції з бісфосфонатами використовують для радіоізотопного методу діагностики. 41. Біологічна роль сполук заліза. Гемоглобін Залізо - біогенний елемент, що міститься в тканинах тварин і рослин. Загальна маса заліза в організмі дорослої людини приблизно 5 г, що становить 0,007%. Металеве залізо малотоксичне, а сполуки Fe(II), Fe(III) та Fe(VI) у великих кількостях небезпечні для здоров'я. Міоглобін, цитохроми, каталаза забезпечують клітинне дихання. Всі ці білки складаються з власне білкових частин і пов'язаних із нею активних центрів. Активний центр є макроциклічне комплексне з'єднання - гем. Як макроциклічний ліганд виступає з'єднання - порфірин. Донорні атоми азоту розташовані по кутах квадрата, у центрі якого розташований іон Fe. У цілому нині комплекс має октаэдрическую конфігурацію. П'ята орбіталь через азот амінокислоти (гістидину) використовується зв'язку гему з білком. Гемоглобін складається з 4 білкових молекул (субодиниць), які утворюють єдиний макромолекулярний агрегат. Кожна субодиниця за будовою аналогічна молекулі міоглобіну. Таким чином, гемоглобін може одночасно зв'язувати чотири молекули2 , а міоглобін – 1. У тканинах є також кілька негемових залізовмісних білкових комплексів. Це, наприклад, ферменти – оксидази, а також білки – накопичувачі (депо) та переносники заліза. Надлишок заліза переноситься з кров'ю білком трансферрином і накопичується у вигляді білка феритину в різних тканинах та органах, особливо в печінці, селезінці, кістковому мозку. Феритин складається з 24 білкових молекул (субодиниць), які утворюють сферу діаметром 12-14 нм. Кожна субодиниця містить порожнину діаметром 7 нм, що містить до 4500 атомів заліза. Таким чином, кожен агрегат феритину може зберігати запас приблизно 100 000 атомів заліза забезпечуючи численні реакції метаболізму за участю цього елемента. На основі законів хімічної рівноваги неважко зрозуміти функціонування гемоглобіну як переносника кисню від легень до тканин. Гемоглобін без кисню (дезоксигемоглобін) є слабкою кислотою і його хімічну формулу можна представити у вигляді HHb+. Приєднання кисню супроводжується відщепленням протону і утворюється оксигемоглобін HbO2 . При цьому має місце рівновага: HHb+ + O2 → HbO2 + N+. При надходженні бідної киснем венозної крові до легень, де парціальний тиск кисню велике (до 20 кПа), його розчинність зростає відповідно до закону Генрі. Це призводить до принципу Ле Шательє до зміщення рівноваги вправо та утворення оксигемоглобіну. Додаткове усунення рівноваги вправо обумовлено тим, що у легень значення рН підвищено (до 7,5). В результаті в легенях дезоксигемоглобін практично повністю (до 97%) насичується киснем і переходить у оксигемоглобін. У капілярах, що пронизують периферичні тканини, парціальний тиск кисню знижується до 5 кПа, а значення рН знижується до 7,2. В результаті рівновага зміщується вліво. У крові, що відтікає з периферії, гемоглобін насичений киснем лише на 65%. 42. Біологічна роль сполук заліза. Моноксид вуглецю СО. Металокомплексні властивості білків, що містять гему, виявляються при дії таких токсичних речовин, як СО (чадний газ) і MCN (ціаніди - солі синильної кислоти). Найбільш важливими з фізіологічного погляду є залізовмісні білки: гемоглобін, міоглобін, цитохроми, пероксидази, каталаза. Гемоглобін - головна складова частина еритроцитів, що забезпечує зовнішнє дихання, будучи переносником кисню від легень до тканин. Залізо Fe та кобальт Со – необхідні мікроелементи живих організмів. Моноксид вуглецю - один з продуктів неповного згоряння палива. Значні кількості цього газу виділяються під час роботи котелень, двигунів внутрішнього згоряння, куріння. При вдиханні СО з повітрям у легенях паралельно з оксигемоглобіном HbO2 утворюється металокомплексна сполука - карбонілгемоглобін HbCO. Константа стійкості HbCO приблизно в 200 разів більша, ніж у HbO2 . Тому навіть малі кількості СО "перехоплюють" значну частку дезоксигемоглобіну, в результаті надходження кисню до органів зменшується. З'являються ознаки гіпоксії – кисневої недостатності. Насамперед страждають нервові тканини. Для детоксикації (усунення отруйної дії) моноксиду вуглецю у багатьох випадках достатньо припинити його надходження та посилити кисневу вентиляцію – вивести потерпілого на свіже повітря. При цьому знову працює принцип Ле Шательє – рівновага зміщується у бік утворення оксигемоглобіну. При великих концентраціях моноксид вуглецю блокує гемсодержащие білки клітинного дихання, і важко уникнути смерті. Аналогічний механізм дії ціанідів, але їхня токсичність вища, ніж у СО. Надходження в кров навіть дуже невеликих кількостей цих речовин призводить до зупинки дихання і смерті. Висока токсичність ціанідів пояснюється високою міцністю зв'язку Fe-CN-, що зумовлює більшу стійкість ціанідгемоглобіну. Кисневе дихання призводить до утворення пероксиду водню H2O2 . Ця речовина має високу окисну здатність. За його взаємодії з біоорганічними сполуками клітин утворюються радикали - дуже активні молекулярні частинки з ненасиченою валентністю, і ініціюється пероксидне окиснення. Під дією радикалів руйнуються найважливіші складові клітини - мембрани і ДНК. У результаті біологічної еволюції природа виробила особливий білок - фермент каталазу, що руйнує пероксид водню. Тим самим обмежується надмірне накопичення цієї речовини, і запобігає руйнуванню клітини. Дія каталази (CatFe2+ ) може бути представлено у вигляді каталітичного циклу з двох послідовних реакцій: CatFe2+ + N2O2 - CatFe2+ × Н2O2 , CatFe2+ × Н2O2 + N2O2 → CatFe2+ + 2Н2O2 + O2 . В результаті руйнуються 2 молекули пероксиду водню, а молекула біокаталізатора CatFe2+ звільняється і може вступати до наступного каталітичного циклу. Цей процес дуже швидкий. Протягом секунди 1 молекула каталази може здійснювати до 20 циклів. 43. Біологічна роль сполук заліза та кобальту При нестачі в організмі заліза може розвинутись хвороба – залізодефіцитна анемія (малокровість). Виникає тканинна киснева недостатність, пов'язана із нестачею заліза для синтезу гемоглобіну. В результаті доставка кисню до периферичних органів знижується, і, відповідно, знижується рівень клітинного дихання, уповільнюється обмін речовин. Введення як лікарські препарати хлориду заліза (II) або сульфату заліза (II) послаблює гостроту захворювання. Для цих же цілей використовується дрібнодисперсний порошок металевого заліза (відновлене залізо, до 1 г на прийом), який легко розчиняється в соляній кислоті шлункового соку. Тому дія цього препарату аналогічна до дії хлориду заліза (II). Однак більш ефективні препарати, що є біонеорганічними комплексами заліза з цукрами, нікотинамідом та іншими органічними речовинами. Такі комплекси добре всмоктуються в кров, із чим і пов'язана їхня фармакологічна ефективність. Цікаво відзначити, що з давніх часів до теперішнього часу для лікування залізодефіцитної анемії застосовують так зване залізне вино - напій, який одержують шляхом наполягання виноградного вина на залізній тирсі. Очевидно, залізо розчиняється у вині (кисле середовище) та утворює комплекси з природними органічними речовинами, які містяться у ньому у великих кількостях. Зрозуміло, що механізм дії древнього напою приблизно той самий, що й у сучасних препаратів. Як і залізо, кобальт також є одним із найважливіших біогенних елементів. Загальна маса кобальту в організмі дорослої людини приблизно 1,2 мг, що становить менше 10%. Близько 100 мг з цієї маси знаходиться у формі ціанкобаламіну (жиророзчинного вітаміну В12 ) та його аналогів. Ця речовина, як і гем, є макроциклічною комплексною сполукою. Як макроциклічний ліганд виступає тетрадентатне з'єднання - порфін. R являє собою складний органічний замісник. В аналогах ціанкобаламіну замість аніону CN виступають різні органічні замісники. Найбільш важливу роль вітамін В12 грає у розвитку та формуванні еритроцитів (еритропоезі). Дефіцит вітаміну В12 (надходження менше 3 мкг на добу) призводить до тяжкого захворювання - злоякісної анемії (малокров'я). Встановлено, що аналоги ціанкобаламіну є активаторами - кофакторами різних ферментів, що беруть участь в еритропоезі. Нестача кофакторів проявляється у дефіциті гемоглобіну та еритроцитів. Рослини та тварини не можуть синтезувати вітамін В12. Його виробляють лише деякі види бактерій. У шлунково-кишковому тракті людини такі бактерії є. Вони синтезують достатню кількість вітаміну В12. Злоякісна анемія пов'язана з порушенням всмоктування вітаміну в кров. Тому прийом таблеток є малоефективним. Ін'єкція вітаміну (100-200 мкг протягом 2 діб) у кров суттєво покращує стан хворого при злоякісному недокрів'ї. 44. Роль d-елементів IB-групи. Застосування їх сполук у медицині Мідь Сі – необхідний мікроелемент живих організмів. Срібло Ag та золото Au – домішкові мікроелементи. Їхні сполуки застосовують у медицині. Мідь - біогенний елемент, що міститься в тканинах тварин і рослин. Загальна маса міді в організмі дорослої людини становить приблизно 100 мг, що становить близько 0,0001%. Приблизно 30% цієї кількості міститься у м'язах. Печінка та мозок також багаті міддю. Металева мідь та її сполуки токсичні. Найбільш важливими з фізіологічної точки зору є білки, що містять мідь - цитохромоксидаза і супероксиддисмутаза. Цитохромоксидаза - один із компонентів дихального ланцюга, локалізованого в мембранах мітохондрій. Забезпечує клітинний подих, відновлюючи кисень до води на кінцевій ділянці дихального ланцюга. Щодня організму потрібно 2,5-5,0 мг міді. При нестачі в організмі міді може розвиватися хвороба – мідьдефіцитна анемія. Мідь необхідна засвоєння заліза, зокрема, при синтезі цитохромоксидази, що містить і залізо, і мідь. При дефіциті міді порушується нормальний розвиток сполучних тканин та кровоносних судин. Отруєння зазвичай пов'язані з випадковим передозуванням інсектицидів, вдиханням порошку металу, заковтуванням розчинів солей міді. Велику небезпеку становлять напої, які у мідних судинах без захисного покриття стінок. Як зовнішній засіб застосовують 0,25% водний розчин сульфату міді CuSO4 при запаленні слизових оболонок та кон'юнктивітах. Малі дози цього препарату можуть застосовуватися під час їди для посилення еритропоезу при недокрів'ї. Срібло та золото В організмі дорослої людини виявляється близько 1 мг срібла, тобто приблизно 10% (1 частина на мільйон) і до 10 мг золота, тобто приблизно 10% (10 частин на мільйон). Антисептичні властивості розчинних солей срібла відомі з давніх часів. Священнослужителі давно знали, що вода ("свята") при зберіганні в срібних судинах довго не псується, тобто не зазнає мікробного забруднення. В даний час ця властивість "срібної" води використовується моряками в далеких плаваннях. Сильні токсичні прояви у дорослої людини спостерігаються при внутрішньому прийомі 7 г AgNO3. У медицині здавна використовуються такі препарати, як кристалічний нітрат срібла AgN03 (ляпіс) та його водні розчини. Давно відомі також препарати колоїдного металевого срібла протаргол (8% Ag) та колларгол (70% Ag), які є дрібнодисперсними порошками з металевим блиском. Кожна частка таких порошків є кристаликом відновленого металевого срібла розміром менше 1 мкм з білковою оболонкою з альбуміну (протаргол) або колагену (коларгол). Білкова оболонка захищає кристали срібла від злипання і забезпечує їх перехід у водне середовище (солюбілізує). Препарати срібла застосовують як протизапальні, антисептичні та в'яжучі засоби. Як ефективні протизапальні засоби застосовують також препарати золота. Найбільш відомі кризанол з 30% вмістом благородного металу, і колоїдне золото. 45. Біологічна роль d-елементів IIB-групи. Застосування їх сполук у медицині Цинк Zn, кадмій Cd, ртуть Hg – мікроелементи. В організмі дорослої людини міститься 1,8 г Zn, 50 мг Cd, 13 мг Hg. Кадмій та ртуть – домішкові елементи. Близько 70% ртуті зосереджено у жировій та м'язовій тканинах. Кадмій локалізується на 30% у нирках, решта – у печінці, легенях, підшлунковій залозі. Цинк – необхідний елемент усіх рослин та тварин. В організмі дорослої людини найбільше цинку в м'язах (65%) та кістках (20%). Решта припадає на плазму крові, печінку, еритроцити. Найбільша концентрація цинку у передміхуровій залозі. Цинк не виявляє змінної валентності. Мабуть, тому його біокомплекси беруть участь у багатьох біохімічних реакціях гідролізу, що йдуть без електронів. Іон Zn входить до складу понад 40 металоферментів, що каталізують гідроліз ефірів та білків. Одним із найбільш вивчених є біонеорганічний комплекс цинку – фермент карбоангідразу (Мг = 30 000), що складається приблизно з 260 амінокислотних залишків. Цинк не входить до складу дипептидаз – ферментів, що каталізують гідроліз дипептидів (речовин, що складаються з 2 амінокислот). Цинк утворює біонеорганічний комплекс з інсуліном – гормоном, що регулює вміст цукру в крові. Потреба людини у цинку повністю задовольняється харчовими продуктами: м'ясними, молочними, яйцями. При нестачі цинку в рослинах порушуються білковий та вуглеводний обмін, гальмується синтез хлорофілу та вітамінів. Дефіцит цинку усувається при використанні добрив, що містять цинк. Токсичність сполук IIB групи збільшується від цинку до ртуті. Водорозчинні сполуки мають подразнюючу дію на шкіру, при попаданні всередину організму викликають отруєння. Токсичні і самі метали - при вдиханні парів цинку (повітря цинкових виробництв) з'являється "металева" лихоманка. Отруєння парами ртуті в Середні віки отримало назву "хвороба божевільного капелюшника". Вміст ртуті у харчових продуктах (у морських, як у Японії) призводить до хвороби міномату. Токсичність ртуті пов'язана з аглютинацією (склеюванням, злипанням) еритроцитів, інгібуванням ферментів. Наприклад, сулема викликає зміну розмірів, осмотичну крихкість та зниження деформованості еритроцитів, яка необхідна для їхнього просування по капілярах. Токсичність кадмію пов'язана з його спорідненістю з нуклеїновими кислотами. Внаслідок його приєднання до ДНК порушується її функціонування. Хронічна інтоксикація кадмієм та ртуттю може порушити мінералізацію кісток. Токсичні елементи можуть замінювати кальцій. Це призводить до утворення апатиту недосконалої структури через спотворення параметрів кристалічного компонента кісткової тканини. В результаті знижується міцність кісток. 46. Токсичні властивості сполук групи IIB (Zn, Cd, Hg) З'єднання Zn, Cd, Hg можуть викликати порушення білкового обміну, що проявляється у виділенні білків плазми через нирки (протеїнурія). Токсична дія сполук групи IIB на організм викликається ще й тим, що іони цих металів вступають у взаємодію з сульфгідрильними SH-групами білків, ферментів та амінокислот. При взаємодії іонів металів з SHгрупами утворюються слабодисоціюючі і, як правило, нерозчинні сполуки. Тому блокування сульфгідрильних груп призводить до пригнічення активності ферментів та згортання білків. Іони двовалентних металів блокують одночасно дві SH групи. У реакціях подібного типу іони металів виступають акцептором, а сірка – донором електронів. Найбільш виражена хімічна спорідненість SH-груп у ртуті. Очевидно, це пов'язано з тим, що комплексоутворюючі властивості ртуті вищі і вона утворює міцніші зв'язки із сіркою. SH групи входять до складу більше 100 ферментів, активність яких може бути пригнічена через блокування цих груп. Тому очевидно, наскільки важливо знати механізм блокування та методи лікування при отруєнні організму металами. Відомо, що токсичні властивості елементів залежить від тієї хімічної форми, як і вони потрапляють у організм. Найбільш токсичні форми, які розчиняються в ліпідах і легко проникають через мембрану в клітину. У літературі описано випадок масового отруєння ртуттю у Японії. Неорганічні сполуки ртуті під впливом ферментів мікроорганізмів перетворювалися на метилртуть. Метилртуть накопичувалася у рибі, та був із їжею потрапляла у організм людини. Поступово концентруючись, метилртуть викликає незворотні руйнації в організмі та смерть. Використання сполук цинку та ртуті в медицині засноване на їх в'яжучому, припікаючому та антисептичному дії. Як очні краплі застосовують 0,25% водний розчин сульфату цинку ZnSО4. У стоматології хлорид цинку використовують для припікання папілом, для лікування запалених слизових оболонок. Застосовується оксид цинку ZnO. Хлорид ртуті (II) (сулема) дуже отруйний, і його водні розчини при великих розведеннях (1: 1000) застосовуються для дезінфекції. Для лікування шкірних та венеричних захворювань застосовують мазі, що містять оксид ртуті (II) HgO та сульфід ртуті (II) HgS. Хлорид ртуті (I) (каломель) погано розчиняється у воді і тому мало отруйний. Цю сіль застосовують у ветеринарії як проносний засіб. Ртуть за звичайних умов - рідкий метал, здатний розчиняти інші метали. При цьому утворюються тверді сплави - амальгами. У стоматології для пломбування зубів здавна застосовували амальгами срібла та кадмію. Вони хімічно інертні, легко розм'якшуються під час нагрівання і тому легко формуються. Джерела ультрафіолетового світла – ртутнокварцеві лампи медичного призначення – містять газоподібну ртуть (пари). При опроміненні світлом цих ламп лікарняних приміщень знищуються мікроорганізми, що у повітрі. За допомогою ультрафіолетових променів лікують різні захворювання шкіри. Таким чином, за характером функціонування та впливу на організм метали IIBгрупи можна розділити на життєво необхідний елемент Zn та токсичні домішкові елементи Cd та Hg. 47. Біологічна роль р-елементів IIIA-групи. Застосування їх сполук у медицині Бор відноситься до домішкових мікроелементів, його масова частка в організмі людини складає 105%. Бор концентрується головним чином у легенях (0,34 мг), щитовидній залозі (0,30 мг), селезінці (0,26 мг), печінці, мозку (0,22 мг), нирках, серцевому м'язі (0,21 мг). . Біологічна дія бору ще недостатньо вивчена. Відомо, що бор входить до складу зубів і кісток, очевидно, у вигляді солей борної кислоти, що важко розчиняються, з катіонами металів. Надлишок бору шкідливий організму людини. Є дані, що надлишок бору пригнічує амілази, протеїнази, зменшує активність адреналіну. За вмістом в організмі людини (105%) алюміній відноситься до домішкових мікроелементів. Алюміній концентрується головним чином у сироватці крові, легень, печінки, кістках, нирках, нігтях, волоссі, входить до структури нервових оболонок мозку людини. Добове споживання алюмінію людиною становить 47 мг. Алюміній впливає розвиток епітеліальної і сполучної тканин, на регенерацію кісткових тканин, впливає обмін фосфору. Алюміній впливає на ферментативні процеси. Надлишок алюмінію в організмі гальмує синтез гемоглобіну, оскільки завдяки досить високій комплексоутворюючій здатності алюміній блокує активні центри ферментів, що беруть участь у кровотворенні. Є дані, що алюміній може каталізувати реакцію трансамінування. Галій - домішковий мікроелемент (зміст в організмі людини 10-6-10-5%). Біологічна роль галію у живих організмах майже не з'ясована. Талій відноситься до дуже токсичних елементів. Іон Т1 схильний подібно до Ag+ утворювати міцні сполуки з сірковмісними лігандами. Внаслідок цього він дуже токсичний, оскільки пригнічує активність ферментів, що містять тіогрупи – SH. Навіть дуже незначні кількості сполук Т1+ при попаданні в організм викликають випадання волосся. Внаслідок близькості радіусів+ і Т1+ вони мають подібні властивості і здатні заміщати один одного в ферментах. Іони Т1 та К є синергістами. Цим пояснюється те що, що ферменти пируваткиназа і диолдегидратаза активуються як іонами До, а й іонами Т1 (іон Т1 заміщає іон До каталітичному центрі ферментів). Синергізм талію і калію проявляється і в тому, що подібно до іонів К іони Т1 накопичуються в еритроцитах. Як протиотрути при отруєнні іонами Т1 використовують сірковмісний ліганд - амінокислоту цистин. На закінчення слід зазначити, що біологічна роль релементів IIIA групи вивчена недостатньо. Нині відомо, що бор та галій взаємодіють у рослинах з інгібіторами їх розвитку поліфенолами, зменшуючи токсичність останніх. Встановлено також безперечну роль алюмінію у побудові епітеліальної та сполучної тканин і, крім того, його участь у ферментативних процесах як активатора, так і як інгібітора. Властивістю інгібувати багато сірковмісних ферментів має іон Т1. Біологічна активність релементів IIIA групи пов'язана головним чином з їхньою здатністю до утворення комплексних сполук з кисневмісними лігандами та нерозчинними фосфатами. 48. Біологічна роль р-елементів IVA-групи. Застосування їх сполук у медицині За вмістом в організмі людини (21,15%) вуглець відноситься до макроелементів. Він входить до складу всіх тканин та клітин у формі білків, жирів, вуглеводів, вітамінів, гормонів. З біологічної точки зору, вуглець є органогеном номер 1. За вмістом в організмі людини (103%) кремній відноситься до домішкових мікроелементів. Найбільше кремнію в печінці, надниркових залозах, волоссі, кришталику. Так як природний діоксид кремнію погано розчинний у воді, то в організм людини він потрапляє не так через травний тракт, як повітряним шляхом через легені у вигляді пилоподібного SiО.2. З порушенням обміну кремнію пов'язують виникнення гіпертонії, ревматизму, виразки, недокрів'я. У медичній практиці застосовують карбід кремнію (IV) SiC – карборунд для шліфування пломб та пластмасових протезів. Діоксид кремнію SiО2 входить до складу силікатних цементів. Необхідно відзначити, що пил, що складається з частинок вугілля, діоксиду кремнію та алюмінію при систематичному впливі на легені, викликає захворювання - пневмоконіози. При дії вугільного пилу – це антракоз, професійне захворювання шахтарів. При вдиханні пилу, що містить S1O2 , виникає силікоз, при дії алюмінієвого пилу – алюміній. За вмістом в організмі людини (10-6-10-5%) германій відноситься до мікроелементів. Біологічна роль остаточно не з'ясовано. З'єднання германію посилюють процеси кровотворення у кістковому мозку. Відомо також, що з'єднання германію малотоксичні. За вмістом в організмі людини (104 %) олово відноситься до мікроелементів. Олово потрапляє в організм людини з кислими продуктами, консервованими в бляшанках, покритих шаром олова. У кислому середовищі олово розчиняється і у формі солі надходить у кров, виявляючи токсичну дію. Однак у дослідах на щурах встановлено, що олово в малих кількостях стимулює дію на зростання щурів. Це дає підстави припускати його необхідність і для людини. Безперечно, з'ясування біологічної ролі цього мікроелемента потребує додаткового вивчення. У медичній практиці знаходять застосування різні матеріали, зокрема пломбувальні, що містять олово. Так, олово входить до складу срібної амальгами (28%) для виготовлення пломб. Свинець та його сполуки, особливо органічні, дуже токсичні. Сполуки свинцю впливають на синтез білка, енергетичний баланс клітини та її генетичний апарат. Багато факторів говорять на користь денатураційного механізму. Встановлено, що свинець - один із елементів, присутність яких у продуктах харчування впливає на розвиток карієсу. З їжею, водою, атмосферним повітрям людина щодня поглинає до 100 мкг свинцю. Свинець депонується переважно в скелеті (до 90%) у формі важкорозчинного фосфату. Масова частка свинцю в організмі людини - 106%. Безпечним для людини вважають добове надходження 0,2-2 мг свинцю. У медичній практиці знайшли застосування як зовнішні в'яжучі антисептичні засоби ацетат свинцю (примочки) та оксид свинцю (II) РЬО (входить до складу пластиру простого свинцевого). 49. Біологічна роль р-елементів VA-групи. Застосування їх сполук у медицині (азот, фосфор) Азот за вмістом в організмі людини (3,1%) відноситься до макроелементів. Якщо враховувати лише масу сухої речовини організму (без води), то у клітинах вміст азоту становить 8-10%. Цей елемент – складова частина амінокислот, білків, вітамінів, гормонів. Азот утворює полярні зв'язки з атомами водню та вуглецю у біомолекулах. У багатьох біонеорганічних комплексах (металоферментах) атоми азоту за донорноакцепторним механізмом пов'язують неорганічну та органічну частини молекули. Разом з киснем та вуглецем азот утворює життєво важливі сполуки - амінокислоти, що містять одночасно аміногрупу з основними властивостями та карбоксильну групу (-СООН) з кислотними властивостями. Аміногрупа виконує дуже важливу функцію і молекулах нуклеїнових кислот. Величезне фізіологічне значення азотовмісних біолігандів - порфіринів, наприклад, гемоглобіну. У біосфері відбувається кругообіг азоту. Азотний цикл має життєво важливе значення для сільського господарства. Необхідно відзначити ще одне важливе в біологічному плані властивість азоту – його розчинність у воді майже така сама, як у кисню. Наявність надлишку азоту в крові може бути причиною розвитку кесонної хвороби. При швидкому підйомі водолазів відбувається різке падіння тиску, відповідно падає розчинність азоту в крові (закон Генрі), і бульбашки елементного азоту, що виходять з крові, закупорюють дрібні судини, що може призвести до паралічу та смерті. За вмістом в організмі людини (0,95%) фосфор відноситься до макроелементів. Фосфор - елементорганоген і грає винятково важливу роль обміні речовин. У формі фосфату фосфор є необхідним компонентом внутрішньоклітинної АТФ. Він входить до складу білків (0,5-0,6%), нуклеїнових кислот, нуклеотидів та інших біологічно активних сполук. Фосфор є основою скелета тварин та людини (кальцій ортофосфат, гідроксилапатит), зубів (гідроксилапатит, фторапатит). Багато реакцій біосинтезу здійснюються завдяки перенесенню фосфатних груп від високоенергетичного акцептора до низькоенергетичного. Фосфатна буферна система є одним із основних буферних систем крові. Живі організми що неспроможні обходитися без фосфору. Значення фосфору полягає і в тому, що цукру та жирні кислоти не можуть бути використані клітинами як джерела енергії без попереднього фосфорилювання. Обмін фосфору в організмі був із обміном кальцію. Це підтверджується зменшенням кількості неорганічного фосфору зі збільшенням вмісту кальцію у крові (антагонізм). Добова потреба людини у фосфорі становить 1,3 г. Фосфор настільки поширений у харчових продуктах, що випадки його явної недостатності (фосфатний голод) практично невідомі. Однак далеко не весь фосфор, що міститься в харчових продуктах, може всмоктуватися, оскільки його всмоктування залежить від багатьох факторів: рН, співвідношення між вмістом кальцію і фосфору в їжі, наявності жирних кислот, але в першу чергу - від вмісту вітаміну D. Цілий ряд сполук фосфору використовують як лікарські препарати. Слід зазначити, що фосфорорганічні сполуки, що містять зв'язок С-Р, є сильними нервово-паралітичними отрутами, входять до складу бойових отруйних речовин. 50. Біологічна роль р-елементів VA-групи (миш'як, сурма, вісмут). Застосування їх у медицині За вмістом в організмі людини миш'як відноситься до мікроелементів. Він концентрується в печінці, нирках, селезінці, легенях, кістках, волоссі. Найбільше миш'яку міститься в мозковій тканині та в м'язах. Миш'як накопичується в кістках і волоссі і протягом кількох років не виводиться з них повністю. Ця особливість використовується в судовій експертизі для з'ясування питання, чи було отруєння сполуками миш'яку. Визначення миш'яку в біологічному матеріалі проводять у нескладному приладі реакції Марша: до біооб'єкта додають цинк і соляну кислоту. Водень, що виділяється при реакції, відновлює будь-яке з'єднання миш'яку до арсину. Якщо водень, що виділяється, містить домішок арсина, то при нагріванні газової суміші відбувається розкладання AsH3 : 2AsH3 = 2As ° + 3Н2. і на стінках трубки для газовиділення утворюється чорний блискучий наліт миш'яку - "миш'якове дзеркало". Реакція Маршу дуже чутлива і дозволяє виявити 7-107 г миш'яку. У відносно великих дозах з'єднання миш'яку дуже отруйні. Як уже згадувалося, токсична дія сполук миш'яку зумовлена блокуванням сульфгідрильних груп ферментів та інших біологічно активних речовин. За вмістом в організмі людини (10%) сурма та вісмут відносяться до мікроелементів. За класифікацією В. В. Ковальського сурму та вісмут відносять до тієї групи мікроелементів, які постійно перебувають у живих організмах, але фізіологічна та біохімічна роль яких практично не з'ясована. Фізіологічна роль сурми, очевидно, подібна до миш'яку. Іони миш'яку As і сурми Sb і меншою мірою вісмут Bi є синергістами. Так, відомо, що в біогеохімічних провінціях з надлишком миш'яку в організмах збільшується вміст не тільки миш'яку, а й сурми. При цьому обидва елементи накопичуються в щитовидній залозі мешканців, пригнічують її функцію та викликають ендемічний зоб. Синергізм миш'яку і сурми пов'язаний з їхньою здатністю до утворення сполук із сірковмісними лігандами. Вісмут більш схильний зв'язуватися з лігандами, що містять аміногрупи. Так, потрапляння розчинних сполук вісмуту в організм призводить до пригнічення ферментів аміно та карбоксиполіпептидаз. Надходження всередину організму водорозчинних сполук сурми, наприклад, стибіну SbH3, надає токсичний ефект подібно до сполук миш'яку. Токсичні та з'єднання вісмуту при ін'єкції. Наприклад, для собак смертельна доза становить 6 мг/кг маси. Однак при попаданні більшості сполук сурми та вісмуту в травний тракт вони практично не надають отруйної дії. Слабка токсичність цих сполук обумовлена тим, що солі Sb(III), Bi(III) у травному тракті піддаються гідролізу з утворенням малорозчинних продуктів, які не всмоктуються у стінки шлунково-кишкового тракту. На цьому ґрунтується застосування лікарських препаратів сурми та вісмуту, наприклад, нітрату вісмуту основного. 51. Біологічна роль р-елементів VIA-групи. Застосування їх сполук у медицині За вмістом в організмі людини (62%) кисень відноситься до макроелементів. Він незамінний і належить до найважливіших елементів, складових основу живих систем, т. е. є органогеном. Кисень входить до складу великої кількості молекул, починаючи від найпростіших і закінчуючи біополімерами. Велика роль кисню у процесах життєдіяльності, оскільки окислення киснем поживних речовин (вуглеводів, білків, жирів) є джерелом енергії, яка потрібна на роботи органів прокуратури та тканин живих організмів. Більшість окислювально-відновних реакцій в організмі протікає за участю кисню та його активних форм. Фагоцитарні (захисні) функції організму також пов'язані з наявністю кисню, і зменшення вмісту кисню в організмі знижує його захисні властивості. У фагоцитах (клітинах, здатних захоплювати та перетравлювати сторонні тіла) кисень 02 відновлюється до супероксидіону. У медичній практиці кисень застосовують для вдихання при хворобливих станах, що супроводжуються кисневою недостатністю (гіпоксією), захворюваннях дихальних шляхів, серцево-судинної системи, отруєння оксидом вуглецю (II), синильною кислотою HCN, а також при захворюваннях з порушеннями функцій дихання. Широко використовується у клінічній практиці гіпербарична оксигенація – застосування кисню під підвищеним тиском. Алотропну модифікацію кисню - озон О3 як дуже сильний окислювач використовують для дезінфекції приміщень, знезараження повітря та очищення питної води. За вмістом в організмі людини (0,16%) сірка відноситься до макроелементів. Як і кисень, вона життєво потрібна. Добова потреба дорослої людини в сірці - близько 4-5 г. Сірка входить до складу багатьох біомолекул - білків, амінокислот (цистину, цистеїну, метіоніну та ін), гормонів (інсуліну), вітамінів (вітамін B1). Багато сірки міститься в каротині волосся, кістках, нервовій тканині. У живих організмах сірка, що входить до складу амінокислот, окислюється. Кінцевими продуктами цього процесу є переважно сульфати. Крім того, утворюються тіосульфати, цементна сірка та політіонові кислоти. За вмістом в організмі (10-5-10-7%) селен відноситься до мікроелементів. Деякі дослідники відносять його до життєво необхідних елементів. Селен надходить із їжею – 55-110 мг на рік. Селен в основному концентрується в печінці та нирках. Концентрація селену у крові становить 0,001-0,004 ммоль/л. Безперечний зв'язок селену з сіркою в живих організмах. При великих дозах селен насамперед накопичується в нігтях і волоссі, основу яких складають сірковмісні амінокислоти. Відома і здатність селену оберігати організм від отруєння ртуттю Hg та кадмієм Cd. Селен сприяє зв'язування цих токсичних металів з іншими активними центрами, з тими, на які їхня токсична дія не впливає. Цікавим є факт взаємозв'язку між високим вмістом селену в раціоні та низькою смертністю від раку. У великих дозах селен токсичний. Розпад сполук селену в організмі тварин призводить до виділення високотоксичного диметилселену, що має часниковий запах. 52. Біологічна роль р-елементів VIIA-групи. Застосування їх сполук у медицині (фтор та хлор) За вмістом в організмі людини хлор (0,15%) відноситься до макроелементів, тоді як інші елементи цієї групи є мікроелементами (зміст - 105 %). Галогени у вигляді різних сполук входять до складу тканин людини та тварин. Хлор і йод відносяться до незамінних елементів, інші є постійними складовими частинами тканин. Маса фтору в організмі людини – близько 7 мг (~105 %). З'єднання фтору концентруються в кістковій тканині, нігтях, зубах. До складу зубів входить близько 0,01% фтору, причому більшість припадає на емаль, що пов'язано з присутністю в ній важкорозчинного фторапатиту. Нестача фтору в організмі призводить до карієсу зубів. Інтерес до біологічної дії фтору пов'язаний насамперед із проблемою зубних хвороб, оскільки фтор оберігає зуби від карієсу. Мінеральну основу зубних тканин (дентину) складають гідроксилапатит, хлорапатит та фторапатит. Дуже часто руйнації піддається не зовнішня поверхня зуба, покрита шаром емалі, а внутрішні ділянки дентину, оголені при пошкодженні емалі. Є припущення, що поки емаль пошкоджена незначно, введення фториду натрію сприяє утворенню фторапатиту, полегшуючи ремінералізацію пошкодження, що почалося. Фторид натрію NaF використовують у медичній практиці як місцеводіючий зовнішній засіб. Застосування NaF ґрунтується на утворенні фторапатиту. При цьому відбувається одночасно і підлужування середовища ротової порожнини, що сприяє нейтралізації кислот, що виробляються бактеріями. Шкідливий як недолік, а й надлишок фтору. При вмісті фтору в питній воді вище за гранично допустиму норму (1,2 мг/л) зубна емаль стає крихкою, легко руйнується, і з'являються інші симптоми хронічного отруєння фтором - підвищення крихкості кісток, кісткові деформації та загальне виснаження організму. Захворювання, що виникає в цьому випадку, називається флуорозом (фторозом). В людини міститься близько 100 г (2790 ммоль) хлору. Хлоридіони відіграють важливу біологічну роль. Вони активують деякі ферменти, створюють сприятливе середовище для дії протолітичних ферментів шлункового соку, забезпечують іонні потоки через клітинні мембрани, беруть участь у підтримці осмотичної рівноваги. Хлоридіон має оптимальний радіус для проникнення через мембрану клітин. Саме цим пояснюється його спільна участь з іонами Na та K у створенні певного осмотичного тиску та регуляції водносольового обміну. Добова потреба в хлориді натрію становить 5-10 г. Як уже розглядалося, NaCl необхідний для вироблення соляної кислоти в шлунку. Крім важливої ролі соляної кислоти у процесі травлення, вона знищує різноманітні хвороботворні бактерії (холери, тифу). Якщо в шлунок з великою кількістю води потрапляють бактерії, то внаслідок розведення HCl не має антибактеріальної дії, і бактерії виживають. Це призводить до захворювання організму. Тому під час епідемій особливо небезпечна сира вода. При недостатній кількості соляної кислоти в шлунку підвищується рН і порушується нормальне травлення, що тяжко відбивається на здоров'ї людини. При зниженій кислотності шлункового соку у медичній практиці використовують розведений розчин соляної кислоти. При запаленні шлунка (гастриті), виразковій хворобі секреція шлункового соку збільшується, підвищується його кислотність. 53. Біологічна роль р-елементів VIIA-групи. Застосування їх сполук у медицині (бром, йод) Маса брому в організмі людини становить близько 7 мг. Він локалізується переважно у залозах внутрішньої секреції, насамперед у гіпофізі. Біологічна роль сполук брому у нормальній життєдіяльності організму ще недостатньо з'ясована. З'єднання брому пригнічують функцію щитовидної залози та посилюють активність кори надниркових залоз. При введенні в організм бромідіонів найбільш чутливою є центральна нервова система. Бромідіони рівномірно накопичуються в різних відділах мозку та діють заспокійливо при підвищеній збудливості. Вони сприяють відновленню порушеної рівноваги між процесами збудження та гальмування. Бромідіони легко всмоктуються у шлунково-кишковому тракті. Токсичність бромідіонів низька. Внаслідок повільного виведення з організму (протягом 30-60 діб) вони можуть накопичуватись (кумулювати), що призводить до розвитку хронічного отруєння, яке називається бромізмом. При прояві хронічних ознак отруєння бромом негайно припиняють прийом бромідних препаратів. Крім того, вводять велику кількість хлориду натрію (до 25 г на добу), щоб збільшити швидкість виділення бромідіонів (принцип Ле Шательє), і призначають рясне питво. У зв'язку з різною індивідуальною чутливістю дозування препаратів брому змінюється від 0,05 до 2,0 г. Йод належить до незамінних біогенних елементів і його сполуки відіграють важливу роль у процесах обміну речовин. Йод впливає синтез деяких білків, жирів, гормонів. У людини міститься близько 25 мг йоду. Із загальної кількості йоду в організмі більше половини знаходиться у щитовидній залозі. Майже весь йод, що міститься в цій залозі, знаходиться у зв'язаному стані (у вигляді гормонів) і лише близько 1% його знаходиться у вигляді йодидіону. Щитовидна залоза здатна концентрувати I- у 25 разів - у порівнянні з вмістом його в плазмі. Щитовидна залоза секретує гормони тироксин та трийодтиронін. Знижена активність щитовидної залози (гіпотиреоз) може бути пов'язана зі зменшенням її здатності накопичувати йодид-іони, а також з нестачею їжі йоду (ендемічний зоб). При ендемічному зобі призначають препарати йоду: (йодид калію KI або йодид натрію NaI) у дозах, що відповідають добовій потребі людини в йоді (0,001 г калію йодиду). У районах, де є дефіцит йоду, для профілактики ендемічного зоба додають до кухонної солі NaI або К! (1-2,5 г на 100 кг). При підвищеній активності щитовидної залози (гіпертиреоз) внаслідок надмірного синтезу тиреоїдних гормонів спостерігається ненормально збільшена швидкість метаболічних процесів. При неефективності зазначених препаратів для лікування гіпертиреозу застосовують препарат радіоактивного йоду 131 I, випромінювання якого руйнує фолікули щитовидної залози та зменшує надлишковий синтез гормонів. Всі релементи VIIA групи фізіологічно активні, а хлор та йод незамінні для життєдіяльності організму. Фтор вважають елементом, необхідним нормального функціонування живих організмів. В організмі галогени взаємозамінні, при цьому спостерігаються випадки як синергізму, так і антагонізму. 54. аерозолі Аерозолями називаються дисперсні системи з газоподібним дисперсійним середовищем. Залежно від агрегатного стану дисперсної фази розрізняють тумани – аерозолі з рідкою дисперсною фазою; дими, пилу - аерозолі з твердою дисперсною фазою; смоги - аерозолі зі змішаною дисперсною фазою. Розміри частинок дисперсної фази аерозолів відповідно до класифікації дисперсних систем коливаються в межах від 107 до 109 м. Як і інші дисперсні системи, аерозолі отримують двома методами: конденсаційними та диспергаційними. Конденсаційний метод Дисперсну фазу одержують із пароподібної шляхом фізичного процесу конденсації молекул до частинок колоїдного розміру. Диспергаційні методи Частинки колоїдних розмірів отримують подрібненням більших агрегатів. Аерозолі мають здатність розсіювати світло. У частинок дисперсної фази аерозолів відсутній подвійний електричний шар, проте частинки дисперсної фази дуже часто несуть електричний заряд. Заряд виникає в результаті тертя або адсорбції іонів газу. Слід зазначити, що часто часточки аерозолю (дрібні і великі) несуть заряд протилежного знака. Розділення частинок за розмірами у великих обсягах аерозолів за висотою може призвести до виникнення електричного поля великої напруженості. Таким чином, у хмарах виникає електричний розряд – блискавка. Аерозолі - кінетично та агрегатно-нестійкі системи, так як на межі розділу фаз відсутній подвійний електричний шар. Тому аерозолі коагулюють із більшою швидкістю, ніж ліозолі. У медицині аерозолі застосовуються в інгаляційній терапії для захисту пошкоджених шкірних покривів, дезінфекції. Іноді утворення аерозолів вкрай небажане. Небезпечні для здоров'я людей аерозолі утворюються в ливарному, керамічному виробництвах, при видобутку та переробці різних корисних копалин (руди, вугілля, азбесту та ін.). Аерозолі, що містять частинки вугілля, викликають захворювання легень – антракоз, кремнію (IV) оксиду – силікоз, азбесту – азбестоз. Алергічні захворювання викликаються аерозолями, утвореними квітковим пилком рослин, пилом, що утворюється при переробці бавовни, льону, конопель і т. д. Суспільство гострі респіраторні захворювання. Шкідливий вплив на організм людини надають аерозолі, що утворюються при згорянні палива, дисперсна фаза яких складається з сажі, смол, золи, канцерогенних вуглеводнів. Особливо небезпечні для здоров'я змоги. Тому боротьба із запиленістю та забрудненістю атмосфери набуває все більшого значення. Очищення повітря від аерозолів досягається введенням безвідходних технологій - уловлюванням частинок дисперсної фази з використанням фільтрів, циклонів (відцентрових пиловловлювачів), електричного поля високої напруги. 55. Емульсії Емульсіями називаються мікрогетерогенні системи, у яких дисперсна фаза і дисперсійне середовище являють собою рідини, що не змішуються. Розміри частинок дисперсної фази - крапельок рідини - знаходяться в межах від 104 до 106 м. Залежно від концентрації дисперсної фази розрізняють емульсії: розбавлені, концентровані та висококонцентровані. Залежно від природи дисперсної фази та дисперсійного середовища розрізняють: 1) емульсії неполярної рідини (ДФ) у полярній (ДС) - прямі емульсії, які називаються емульсіями першого роду або емульсіями типу "масло/вода" (М/В); 2) емульсії полярної рідини (ДФ) у неполярній (ДС) - зворотні емульсії, які називаються емульсіями другого роду або емульсіями типу "вода/масло" (В/М). Тут ДФ і ДС - дисперсна фаза та дисперсійне середовище відповідно, "вода" - будь-яка полярна рідина, "масло" - неполярна. Тип емульсії можна встановити: 1) виміром електричної провідності; 2) змішанням з надлишком полярної чи неполярної рідини; 3) фарбуванням водорозчинними або маслорозчинними барвниками; 4) зі змочування та розтікання краплі емульсії на гідрофобній або гідрофільній поверхні. Емульсії, як та інші дисперсні системи, можна отримати методами конденсації та диспергування. Емульсії як грубі дисперсії - кінетично та агрегатнонестійкі системи. При зіткненні крапель дисперсної фази відбувається їхнє злиття (коалесценція). В результаті коалесценції емульсія розшаровується на дві безперервні рідкі фази. Для підвищення стійкості емульсій використовують стабілізатори – емульгатори. Це ПАР, які в результаті адсорбції на межі розділу фаз знижують величину міжфазного натягу та утворюють механічно міцну адсорбційну плівку. Якщо емульгатор - іоногенне ПАР, він повідомляє крапелькам дисперсної фази електричний заряд однакового знака, і крапельки відштовхуються. Тип емульсії, що утворюється, залежить від властивостей емульгатора. Дисперсійним середовищем завжди виявляється та рідина, яка краще розчиняє або змочує емульгатор. Як емульгатори використовують солі вищих жирних кислот, складні ефіри вищих жирних кислот і багатоатомних спиртів, довголанцюгові аміни. Емульсії широко зустрічаються у природі. Емульсіями є молоко, вершки, сметана, вершкове масло, яєчний жовток, чумацький сік рослин, сира нафта. Емульсії, що містять лікарські речовини, широко застосовують у медицині: першого роду (М/В) для внутрішнього застосування, другого роду (В/М) - для зовнішнього. Відомо, що рослинні та тваринні жири краще засвоюються організмом в емульгованому вигляді (молоко). Як емульгатори в цьому випадку виступають похідні холевої та дезоксихолевої кислоти. Іноді виникає потреба зруйнувати емульсію, що утворилася. Руйнування емульсії називають деемульгуванням. Деемульгування проводять підвищенням та зниженням температури, впливом електричного поля, центрифугуванням, додаванням електролітів та спеціальних речовин - деемульгаторів. Деемульгатори є ПАР з більшою поверхневою активністю, ніж емульгатори, але не володіють здатністю утворювати механічно міцний адсорбційний шар. 56. Колоїдні ПАР Колоїдними ПАР називаються речовини, які з тим самим розчинником залежно від умов утворюють істинний і колоїдний розчин. Як було вже сказано, молекули ПАР дифільні. Вони складаються з неполярних та полярних угруповань. У неполярних радикалів, наприклад, вуглеводневих ланцюгів, відсутня спорідненість до полярного розчинника - води, у полярних груп вона досить велика. Між неполярними групами існує гідрофобна (вандерваальсова) взаємодія. При довжині ланцюга приблизно 1022 вуглецевих атомів за рахунок гідрофобних взаємодій вуглеводневих радикалів і сильної взаємодії полярних груп з водою відбувається асоціація молекул ПАР і утворюються міцели. Мінімальна концентрація колоїдного ПАР, починаючи з якої в його розчині відбувається утворення міцел, одержала назву критичної концентрації міцелоутворення (ККМ). Форма міцел, що утворюються, залежить від концентрації розчину. При невеликих концентраціях колоїдного ПАР утворюються сферичні міцели. Підвищення концентрації колоїдного розчину ПАР призводить спочатку до зростання їх числа, а потім і до зміни форми. При більш високих концентраціях замість сферичних міцел утворюються циліндричні та пластинчасті. Значення ККМ залежить від різних факторів: природи колоїдного ПАР, температури та присутності домішок сторонніх речовин, особливо електролітів. ККМ можна визначити за властивостями розчину, що залежать від числа та розмірів кінетично активних частинок, зокрема щодо змін осмотичного тиску, поверхневого натягу, електричної провідності, оптичних характеристик. Так як при переході "справжній розчин - колоїдний розчин" змінюється розмір кінетично активних частинок (іонів, молекул, міцел) та їх число, то на графіку "властивість - концентрація" з'являється точка зламу, що відповідає ККМ. Однією з найважливіших властивостей розчинів колоїдних ПАР, через яку вони знаходять широке застосування в різних галузях народного господарства та в медицині, є солюбілізація. Механізм солюбилізації полягає у розчиненні неполярних речовин у гідрофобному ядрі міцел. Явище солюбилізації широко використовується у різних галузях народного господарства: у харчовій промисловості, у фармацевтичній (для отримання рідких форм лікарських речовин). У системі "вода - фосфоліпід" при струшуванні, перемішуванні утворюються сферичні міцели - ліпосоми. Молекули фосфоліпідів утворюють у ліпосомах бислойную мембрану, у якій полярні групи звернені до води, а неполярні одна до одної. Ліпосоми можна як модель біологічних мембран. З їх допомогою можна вивчати проникність мембран та вплив на неї різного роду факторів для різних сполук. Ліпосоми широко використовуються для спрямованої доставки лікарських речовин до тих чи інших органів чи зон ураження. За допомогою ліпосом можна транспортувати лікарські речовини усередину клітин. Ліпосомальні мембрани використовуються в імунологічних дослідженнях щодо взаємодії між антитілами і антигенами. Автори: Дроздова М.В., Дроздов
▪ Історія економічної думки. Курс лекцій ▪ Соціальна педагогіка Шпаргалка ▪ Гроші, кредити, банки. Шпаргалка
Новий спосіб управління та маніпулювання оптичними сигналами
05.05.2024 Приміальна клавіатура Seneca
05.05.2024 Запрацювала найвища у світі астрономічна обсерваторія
04.05.2024
▪ Розділ сайту Основи першої медичної допомоги (ОПМП). Добірка статей ▪ стаття Дякую, не чекав... Крилатий вираз ▪ стаття Хто має як Нобелівську, так і Шнобелівську премії? Детальна відповідь ▪ стаття Осот рожевий. Легенди, вирощування, способи застосування ▪ стаття Японський лак. Прості рецепти та поради ▪ стаття Зарядний пристрій із таймером. Енциклопедія радіоелектроніки та електротехніки
Головна сторінка | Бібліотека | Статті | Карта сайту | Відгуки про сайт www.diagram.com.ua |






 Arabic
Arabic Bengali
Bengali Chinese
Chinese English
English French
French German
German Hebrew
Hebrew Hindi
Hindi Italian
Italian Japanese
Japanese Korean
Korean Malay
Malay Polish
Polish Portuguese
Portuguese Spanish
Spanish Turkish
Turkish Ukrainian
Ukrainian Vietnamese
Vietnamese

 Дивіться інші статті розділу
Дивіться інші статті розділу 