
|
КОНСПЕКТИ ЛЕКЦІЙ, ШПАРГАЛКИ
Госпітальна терапія. Конспект лекцій: коротко, найголовніше
Довідник / Конспекти лекцій, шпаргалки Зміст
ЛЕКЦІЯ №1. Захворювання серцево-судинної системи. Ревматизм Ревматизм (хвороба Сокольського-Буйо) - це системне запальне захворювання сполучної тканини з переважною локалізацією процесу в серцево-судинній системі, яке розвивається у схильних до нього осіб (як правило, це особи молодого віку) у зв'язку з гострою інфекцією β-гемолітичним стрептококом групи А . Це визначення хвороби було дано 1989 р. В. А. Насоновим. Воно відбиває всі характерні риси захворювання: 1) переважне ураження серцево-судинної системи; 2) роль патологічної спадковості; 3) значення стрептококової інфекції. Сутність хвороби полягає в ураженні всіх оболонок серця, але головним чином міокарда та ендокарда з виникненням деформації клапанного апарату – вади серця та подальшим розвитком серцевої недостатності. Поразка інших органів та систем при ревматизмі має другорядне значення і не визначає його тяжкості та подальшого прогнозу. Етіологія. Бета-гемолітичні стрептококи групи А є причиною ураження верхніх дихальних шляхів. Саме тому виникненню ревматизму, як правило, передують ангіна, загострення хронічного тонзиліту, а в крові у хворих виявляється підвищена кількість стрептококового антигену та протистрептококових антитіл (АСЛ-О, АСГ, АСК, антидезоксирибонуклеази В) (анти-ДНКази В). Такий зв'язок з попередньою стрептококовою інфекцією особливо виражений при гострій течії ревматизму, що супроводжується поліартритом. У розвитку ревматизму відіграють роль вікові, соціальні фактори (несприятливі побутові умови, недостатнє харчування), має значення і генетична схильність (ревматизм - полігенно успадковане захворювання, добре відомо існування "ревматичних" сімей), яка полягає в гіперімунній відповіді на антигени стрептокока, схильності до аутоімунних та імунокомплексних процесів. Патогенез. При ревматизмі виникає складна та різноманітна імунна відповідь (реакції гіперчутливості негайного та уповільненого типів) на численні антигени стрептокока. При попаданні в організм інфекції виробляються протистрептококові антитіла та утворюються імунні комплекси (антигени стрептокока + антитіла до них + комплемент), які циркулюють у крові та осідають у мікроциркуляторному руслі. Токсини і ферменти стрептокока також надають шкідливу дію на міокард і сполучну тканину. Внаслідок генетично обумовленого дефекту імунної системи з організму хворих недостатньо повно та швидко елімінуються стрептококові антигени та імунні комплекси. Тканини таких хворих мають підвищену схильність фіксувати ці імунні комплекси. Тут грають роль і перехресно реагують антитіла, які, утворюючись на антигенах стрептокока, здатні реагувати з тканинними, зокрема кардіальними, антигенами організму. У відповідь розвивається запалення на імунній основі (на кшталт гіперчутливості негайного типу), при цьому факторами, що реалізують запальний процес, є лізосомні ферменти нейтрофілів, які фагоцитують імунні комплекси і руйнуються при цьому. Цей запальний процес локалізується в сполучній тканині переважно серцево-судинної системи та змінює антигенні властивості її та міокарда. В результаті розвиваються аутоімунні процеси на кшталт гіперчутливості уповільненого типу, і в крові хворих виявляються лімфоцити, що реагують із серцевою тканиною. Цим клітинам надають великого значення походження органних уражень (головним чином серця). У сполучній тканині при ревматизмі виникають фазові зміни: борошно набухання - фібриноїдні зміни - фібриноїдний некроз. Морфологічним виразом імунних порушень є клітинні реакції – інфільтрація лімфоцитами та плазмоцитами, утворення ревматичної, або ашофф-талалаївської, гранульоми. Патологічний процес завершується склерозуванням. Іншим морфологічним субстратом ураження серця при ревмокардиті є неспецифічна запальна реакція, аналогічна такій у суглобах та серозних оболонках: набряк міжм'язової сполучної тканини, випотівання фібрину, інфільтрація нейтрофілами та лімфоцитами. Захворювання тече хвилеподібно, загострюючись під впливом інфекції або неспецифічних факторів (переохолодження, фізичної напруги, стресу тощо), що пов'язане з аутоімунним характером патологічного процесу. При поразці серця запальний процес може поширюватися попри всі оболонки серця (панкардит) чи ізольовано кожну з оболонок. Морфологічні зміни при ревматизмі виявляються насамперед у міокарді, тому саме міокардит у ранні терміни визначає клінічну картину. Запальні зміни в ендокарді (вальвуліт, бородавчастий ендокардит), ураження сухожильних ниток та фіброзного кільця клінічно виявляються через 6-8 тижнів після атаки ревматизму. Найчастіше уражається мітральний клапан, потім аортальний та тристулковий. Клапан легеневої артерії при ревматизмі практично ніколи не уражається. Класифікація ревматизму. В даний час прийнято класифікацію та номенклатуру ревматизму, схвалену в 1990 р. Всесоюзним науковим товариством ревматологів, що відображає фазу перебігу процесу, клініко-анатомічну характеристику ураження органів і систем, характер перебігу та функціональний стан серцево-судинної системи (див. табл. 1). клінічна картина. Всі прояви хвороби можна розділити на серцеві та позасерцеві. Описувати клінічну картину хвороби можна з цих позицій. І етап: виявляється зв'язок хвороби з перенесеною інфекцією. У типових випадках через 1-2 тижні після ангіни або гострого респіраторного захворювання підвищується температура тіла, іноді до 38-40 ° C, з коливаннями протягом доби в межах 1-2 ° C і сильним потом (як правило, без ознобу). При повторних атаках ревматизму рецидив хвороби часто розвивається під впливом неспецифічних факторів (наприклад, переохолодження, фізичне навантаження, оперативне втручання). Таблиця 1 Класифікація ревматизму
Найбільш частим проявом ревматизму є ураження серця – ревмокардит: одночасне ураження міокарда та ендокарда. У дорослих ревмокардит протікає легко. Хворі скаржаться на слабкі болі або неприємні відчуття в області серця, легку задишку при навантаженні, значно рідше відзначають перебої або серцебиття. Ці симптоми не специфічні для ревматичного ураження серця і можуть спостерігатися при інших його захворюваннях. Природа таких скарг уточнюється наступних етапах діагностичного пошуку. Ревмокардит у хворих молодого віку, як правило, протікає важко: від самого початку хвороби відзначаються сильна задишка при навантаженні та у спокої, постійні болі в ділянці серця, серцебиття. Можуть з'являтись симптоми недостатності кровообігу у великому колі у вигляді набряків та тяжкості в області правого підребер'я (за рахунок збільшення печінки). Всі ці симптоми вказують на дифузний міокардит тяжкого перебігу. Перикардит так само, як і позасерцеві прояви ревматизму, зустрічається рідко. При розвитку сухого перикардиту хворі відзначають лише постійні болі у серці. При ексудативному перикардиті, що характеризується накопиченням у серцевій сумці серозно-фібринозного ексудату, біль зникає, оскільки відбувається роз'єднання запалених листків перикарда ексудатом, що накопичується. З'являється задишка, яка посилюється при горизонтальному положенні хворого. Внаслідок утруднення припливу крові до правого серця з'являються застійні явища у великому колі (набряки, тяжкість у правому підребер'ї внаслідок збільшення печінки). Найбільш характерним для ревматизму є ураження опорно-рухового апарату як ревматичного поліартриту. Хворі відзначають швидко наростаючий біль у великих суглобах (колінних, ліктьових, плечових, гомілковостопних, променево-зап'ясткових), неможливість активних рухів, збільшення суглобів в обсязі. Відзначається швидкий ефект після застосування ацетилсаліцилової кислоти та інших нестероїдних протизапальних препаратів з усуненням протягом декількох днів, часто і кількох годин усіх суглобових проявів. Ревматичні поразки нирок також дуже рідкісні, виявляються лише за дослідженні сечі. Поразки нервової системи при ревматизмі трапляються рідко, переважно в дітей віком. Скарги схожі зі скаргами при енцефаліті, менінгоенцефаліті, церебральному васкуліті іншої етіології. Заслуговує на увагу лише "мала хорея", що зустрічається у дітей (частіше дівчаток) і проявляється поєднанням емоційної лабільності та насильницьких гіперкінезів тулуба, кінцівок та мімічної мускулатури. Абдомінальний синдром (перитоніт) зустрічається майже виключно у дітей та підлітків із гострим первинним ревматизмом. Характеризується раптовістю виникнення, лихоманкою, а також ознаками дисфагії (виникають дифузні або локалізовані переймоподібні болі, нудота, блювання, затримка або почастішання випорожнень). На ІІ етапі діагностичного пошуку невелике значення має виявлення ознак ураження серця. При первинному ревмокардиті серце зазвичай не збільшено. При аускультації виявляються приглушений I тон, іноді поява III тону, м'який шум систоли на верхівці. Ця симптоматика зумовлена змінами міокарда. Однак наростання інтенсивності, тривалості та стійкості шуму можуть вказувати на формування недостатності мітрального клапана. Впевнено судити про формування пороку можна через 6 місяців після початку атаки за збереження наведеної аускультативної картини. У разі ураження клапана аорти може вислуховуватись протодіастолічний шум у точці Боткіна, а звучність II тону може зберігатися. Лише через багато років, після формування вираженої недостатності клапана аорти, до цієї аускультативної ознаки приєднується ослаблення (або відсутність) II тону у II міжребер'ї праворуч. У хворих на поліартрит відзначаються деформація суглобів за рахунок запалення синовіальної оболонки та навколосуглобових тканин, болючість при пальпації суглоба. В області уражених суглобів можуть з'являтися ревматичні вузлики, які розташовуються на передпліччях і гомілках над кістковими виступами. Це дрібні, щільні консистенції безболісні утворення, що зникають під впливом лікування. Кільцеподібна еритема (ознака, практично патогномонічна для ревматизму) - це рожеві кільцеподібні елементи, що не сверблять, що розташовуються на шкірі внутрішньої поверхні рук і ніг, живота, шиї та тулуба. Ця ознака зустрічається виключно рідко (у 1-2% хворих). Ревматичні пневмонії та плеврити мають ті ж фізикальні ознаки, що й аналогічні захворювання банальної етіології. У цілому нині позасерцеві поразки нині спостерігаються дуже рідко, в осіб молодого віку при гострому перебігу ревматизму (за наявності високої активності - III ступеня). Вони нерезко виражені, швидко піддаються зворотному розвитку під час проведення протиревматичної терапії. На ІІІ етапі діагностичного пошуку дані лабораторно-інструментального дослідження дозволяють встановити активність патологічного процесу та уточнити ураження серця та інших органів. При активному ревматичному процесі лабораторні дослідження виявляють неспецифічні острофазові та змінені імунологічні показники. Острофазові показники: нейтрофілоз зі зсувом лейкоцитарної формули крові вліво; збільшення вмісту 2-глобулінів, що змінюється підвищенням рівня – глобулінів; підвищення вмісту фібриногену; поява С-реактивного білка; зростає ШОЕ. Що стосується імунологічних показників, то підвищуються титри протистрептококових антитіл (антигіалуронідази та антистрептокінази більше 1: 300, анти-О-стрептолізину більше 1: 250). На ЕКГ іноді виявляються порушення ритму та провідності: минуща атріовентрикулярна блокада (частіше I ступеня – подовження інтервалу Р-Q, рідше – II ступеня), екстрасистолія, атріовентрикулярний ритм. У багатьох хворих реєструється зниження амплітуди зубця Т до появи негативних зубців. Зазначені порушення ритму та провідності нестійкі, у процесі протиревматичної терапії швидко зникають. Якщо зміни на ЕКГ стійкі і залишаються після ліквідації ревматичної атаки, слід думати про органічному ураженні міокарда. При фонокардіографічне дослідження уточнюються дані аускультацій: ослаблення I тону, поява III тону, систолічний шум. У разі формування вад серця на ФКГ з'являються зміни, що відповідають характеру клапанного ураження. Рентгенологічно при першій атаці ревматизму будь-яких змін не виявляється. Лише при тяжкому ревмокардиті у дітей та осіб молодого віку можна виявити збільшення серця за рахунок дилатації лівого шлуночка. При розвитку ревмокардиту на тлі вже наявної вади серця рентгенологічна картина буде відповідати конкретному пороку. Ехокардіографічне дослідження при первинному ревмокардиті будь-яких характерних змін не виявляє. Лише при тяжкому перебігу ревмокардиту з ознаками серцевої недостатності на ехокардіограмі виявляють ознаки, що вказують на зниження скорочувальної функції міокарда та розширення порожнин серця. Діагностика. Розпізнавання первинного ревматизму становить велику труднощі, оскільки найчастіші його прояви, такі як поліартрит та поразка серця, неспецифічні. В даний час найбільшого поширення набули великі та малі критерії ревматизму Американської асоціації кардіологів. Поєднання двох великих або одного великого та двох малих критеріїв вказує на більшу ймовірність ревматизму лише у випадках попередньої стрептококової інфекції. При поступовому початку ревматизму має значення запропонована А. І. Нестеровим у 1973 р. (див. табл. 2) синдромна діагностика: клініко-епідеміологічний синдром (зв'язок зі стрептококовою інфекцією); клініко-імунологічний синдром (ознаки неповної реконвалесценції, артралгії, підвищення титрів протистрептококових антитіл, а також виявлення диспротеїнемії та острофазових показників); кардіоваскулярний синдром (виявлення кардиту, а також екстракардіальних уражень) (див. табл. 3). Таблиця 2 Критерії ревматизму
Таблиця 3 Ступені ревматизму
Диференціальна діагностика. Ревматичний поліартрит необхідно диференціювати з неревматичними (див. табл. 4). Таблиця 4 Ревматичні та неревматичні поліартрити
Підозрілі щодо ревматизму такі захворювання та симптоми: 1) ендокардит; 2) міокардит; 3) перикардит; 4) вади серця; 5) порушення ритму та провідності; 6) гостра та хронічна недостатність серця; 7) тривалий субфебрилітет; 8) вузлувата еритема; 9) кільцеподібна еритема; 10) підшкірні вузлики; 11) гострий алергічний поліартрит; 12) хорея. Жоден із перелічених вище клінічних синдромів не є специфічним для цього захворювання. Лише поєднання патології серця хоча б з однією позакардіальною основною ознакою ревматизму дає підставу запідозрити ревматизм. Розпізнавання власне ревмокардиту здійснюється на підставі таких симптомів, як задишка та серцебиття, підвищена стомлюваність, біль у ділянці серця та порушення ритму серцевих скорочень, шуми, іноді ритм галопу та ослаблення I тону. Велике значення у діагностиці ревмокардиту відіграє виявлення патології на ЕКГ. При ревматизмі вона обумовлена міокардитом, перикардитом та вадами серця. Динамічне спостереження дозволяє відрізнити незворотні зміни, характерні для гіпертрофії різних відділів серця при пороках, від тимчасових, що свідчать про поточний запальний процес. Лікування. Позитивному ефекту при лікуванні, а також попередження розвитку вад серця сприяє рання діагностика та проведення індивідуального лікування, яке засноване на оцінці виду перебігу, активності патологічного процесу, ступеня вираженості кардиту, варіанта клапанної вад серця. Мають значення стан міокарда, інших тканин та органів, професія хворого та ін. Таким чином, весь комплекс лікування ревматизму складається з протимікробної та протизапальної терапії, заходів, спрямованих на відновлення імунологічного гомеостазу. Рекомендується використання раціонального збалансованого харчування, спрямованість на адаптацію до фізичних навантажень, підготовка до трудової діяльності, своєчасне оперативне лікування пацієнтів зі складними вадами серця. Всім пацієнтам під час активної фази ревматизму показаний пеніцилін (1 200 000-1 500 000 ОД на 6 прийомів на день, кожні 4 години), що надає бактерицидну дію на всі типи А-стрептокока. Курс лікування – 2 тижні в період активної фази ревматизму, надалі потрібен переведення на пролонгований препарат біцилін-5 (1 ОД). При непереносимості пеніциліну можна призначати еритроміцин 500 мг 000 рази на день. Препаратами з протизапальним ефектом, що застосовуються у сучасному лікуванні активної фази ревматизму, є глюкокортикостероїди, саліцилові, індольні похідні, деривати фенілоцтової кислоти та ін. Преднізолон застосовується по 20-30 мг на день (протягом 2 тижнів, потім доза знижується на 2,5-5 мг кожні 5-7 днів, всього на курс 1,5-2 місяці) при первинному та зворотному з ІІІ та ІІ ступенем активності процесу ревмокардиту, при полісерозитах та хореї, при розвитку серцевої недостатності внаслідок активного кардиту. В останньому випадку кращий триамцинолон у дозі 12-16 мг на день, оскільки він має невелику здатність порушувати електролітний баланс. Кортикоїдні засоби впливають на водно-сольовий обмін, тому при лікуванні повинні використовуватися хлорид калію по 3-4 г/добу, панангін та інші; -6 мг/добу, фуросемід по 8-40 мг/добу та ін), при ейфорії - транквілізатори та ін. Широко застосовуються при ревматизмі та нестероїдні протизапальні препарати: середні дози ацетилсаліцилової кислоти – 3-4 г на день, рідше 5 г на день та більше. Показання для застосування саліцилатів: 1) мінімальний ступінь активності, невеликої вираженості кардиту, в основному міокардиту; 2) тривале лікування ревматизму, підозра на латентний перебіг; 3) затяжне лікування при зменшенні активності перебігу процесу та припинення використання кортикостероїдів, а також після завершення лікування у стаціонарі; 4) зворотний ревмокардит, що протікає на тлі важких вад серця і недостатності кровообігу, оскільки саліцилати не здатні затримувати рідину, попереджають утворення тромбів, є стимуляторами дихального центру; 5) зниження ймовірності загострення ревматизму у весняно-осінні періоди, а також після перенесених інтеркурентних інфекцій (разом з антибіотиками). Ацетилсаліцилову кислоту застосовують по 1 г 3-4 рази на добу після їди 1-3 місяці і більше при нормальній переносимості та при дотриманні контролю над побічними ефектами. Успішному застосуванню похідної індолоцтової кислоти – індометацину при ревматизмі вже понад 20 років. Він має виражений лікувальний ефект: зникають суб'єктивні симптоми кардиту (кардіалгії, серцебиття, задишка) вже до 8-10-го дня терапії, а об'єктивні ознаки - до 14-16-го дня. Ще швидше відбувається зникнення поліартриту та полісерозиту. При лікуванні ревматизму має значення поєднання трьох основних етапів: стаціонар – поліклініка – курорт. У стаціонарі здійснюють лікування препаратами, перерахованими вище. Після зменшення активності ревматизму та нормалізації стану хворого переводять на II етап – лікування у ревматологічному санаторії. Основна мета цього етапу – продовження лікування нестероїдними протизапальними препаратами, які індивідуально підбирають у стаціонарі, амінохіноліновими похідними, біцилін-5, реабілітація. III етап включає диспансерне спостереження та профілактичне лікування. Це здійснення лікувальних заходів, спрямоване заключну ліквідацію активного перебігу ревматичного процесу; проведення симптоматичного лікування розладу кровообігу у пацієнтів із вадами серця; вирішення питань реабілітації, працездатності та працевлаштування; здійснення первинної профілактики ревматизму та вторинної профілактики рецидивів захворювання. ЛЕКЦІЯ №2. Захворювання серцево-судинної системи. Кардіоміопатії. Дилатаційна кардіоміопатія 1. Кардіоміопатії Кардіоміопатії - первинні ізольовані ураження міокарда незапального характеру невідомої етіології (ідіопатичні), вони не мають зв'язку з клапанними вадами або внутрішньосерцевими шунтами, артеріальною або легеневою гіпертензією, ішемічною хворобою серця або системними захворюваннями (як-от: колагенози, амілоїдоз, гемохромоз, гемохромат). у фінальній стадії хвороби розвиваються тяжка застійна серцева недостатність та складні порушення серцевого ритму та прохідності. Класифікація кардіоміопатій: 1) дилатаційна кардіоміопатія: а) ідіопатична; б) токсична; в) інфекційна; г) при колагенозах; 2) гіпертрофічна; 3) рестриктивна; 4) аритмічна дисплазія правого шлуночка; 5) поєднання одного з чотирьох видів кардіоміопатій з артеріальною гіпертензією. 2. Дилатаційна кардіоміопатія Дилатаційна кардіоміопатія (ДКМП) – захворювання серцевого м'яза, що характеризується дифузним розширенням всіх камер серця (переважно лівого шлуночка), при якому на першому плані стоїть патологія насосної функції серця і як наслідок – хронічна серцева недостатність (звідси друга назва – застійна, коли серце не здатне повноцінно перекачувати кров і вона "застоюється" у тканинах та органах організму). М'язова стінка серця при цьому залишається або незміненою, або різною мірою гіпертрофується. Захворювання та фактори, що передували розвитку ДКМП, описані у наведеній нижче таблиці (див. табл. 5). Таблиця 5 Захворювання та фактори, що передували розвитку ДКМП
Це найпоширеніша форма ураження серцевого м'яза. Захворюваність становить 5-8 випадків на 100 000 чоловік на рік. Точного сімейного анамнезу у цих пацієнтів не простежується. Чоловіки хворіють у 2-3 рази частіше за жінок. Патогенез. В результаті запального процесу в серцевому м'язі (міокардиту) відбувається загибель окремих клітин у різних її ділянках. Запалення у своїй носить вірусний характер, а клітини, уражені вірусом, стають чужорідними агентами для організму. Відповідно, з появою в організмі антигенів розвивається комплекс реакцій імунної відповіді, спрямованих на їх знищення. Поступово відбувається заміщення загиблих м'язових клітин на сполучну тканину, яка не має здатності до розтяжності та скоротливості, властивої міокарду. Внаслідок втрати основних функцій міокарда серце втрачає здатність функціонувати як насос. У відповідь на це (як компенсаторна реакція) камери серця розширюються (тобто відбувається їх дилатація), а в частині міокарда, що залишилася, відбувається потовщення і ущільнення (тобто розвивається його гіпертрофія). Для збільшення доставки кисню органам та тканинам організму виникає стійке почастішання серцевого ритму (синусова тахікардія). Ця компенсаторна реакція лише на якийсь час покращує насосну функцію серця. Однак можливості дилатації та гіпертрофії міокарда обмежуються кількістю життєздатного міокарда та є індивідуальними для кожного конкретного випадку захворювання. При переході процесу на стадію декомпенсації розвивається хронічна серцева недостатність. Однак на цьому етапі набуває чинності ще один компенсаторний механізм: тканини організму збільшують екстракцію кисню з крові порівняно зі здоровим організмом. Але цей механізм недостатній, оскільки зниження насосної функції серця веде до зменшення надходження до органів і тканин кисню, який є необхідним для нормальної життєдіяльності, при цьому кількість вуглекислого газу в них збільшується. У 2/3 хворих на порожнинах шлуночків на пізніх стадіях хвороби утворюються пристінкові тромби (внаслідок зниження насосної функції серця, а також при нерівномірності скорочення міокарда в камерах серця) з подальшим розвитком емболії малого або великого кола кровообігу. Патогістологічні та патоморфологічні зміни в серці. Форма серця стає кулястою, маса його збільшується від 500 до 1000 г, переважно за рахунок лівого шлуночка. Міокард стає в'ялим, тьмяним, з помітними білуватими прошарками сполучної тканини, є характерне чергування гіпертрофованих та атрофічних кардіоміоцитів. Мікроскопічно виявляється дифузний фіброз, він може поєднуватись як з атрофією, так і з гіпертрофією кардіоміоцитів, у яких відзначаються значне збільшення об'єму ядер, кількості мітохондрій, гіперплазія апарату Гольджі, збільшення кількості міофібрил, вільних та пов'язаних з ендоплазматичним ретикулумом риб. клінічна картина. Специфічних ознак захворювання немає. Клінічна картина поліморфна і визначається: 1) симптомами серцевої недостатності; 2) порушеннями ритму та провідності; 3) тромбоемболічний синдром. Всі ці явища розвиваються на термінальній стадії хвороби, у зв'язку з чим розпізнавання ДКМП до появи перерахованих симптомів становить значні труднощі. Найчастіше прогноз захворювання визначається поразкою лівого шлуночка серця. До серцевої недостатності ДКМП протікає латентно. Найбільш частими скаргами серцевої недостатності, що вже настала, є скарги на зниження працездатності, підвищену стомлюваність, задишку при фізичному навантаженні, а потім у спокої. Ночами турбує сухий кашель (еквівалент серцевої астми), пізніше – типові напади ядухи. У хворих спостерігаються характерні ангінозні болі. При розвитку застійних явищ у великому колі кровообігу з'являються тяжкість у правому підребер'ї (внаслідок збільшення печінки), набряки ніг. Діагностика. При діагностиці захворювання важливою ознакою є значне збільшення серця (ознаки клапанної вади серця чи артеріальної гіпертензії відсутні). Кардіомегалія проявляється розширенням серця в обидві сторони, що визначається перкуторно, а також зміщенням верхівкового поштовху вліво та вниз. У тяжких випадках вислуховуються ритм галопу, тахікардія, шуми відносної недостатності мітрального або тристулкового клапанів. У 20% випадків розвивається мерехтіння передсердь. Артеріальний тиск зазвичай нормальний або трохи підвищений (внаслідок серцевої недостатності). Біохімічні дослідження крові та сечі дозволяють виявити різні токсичні речовини, а також дефіцит вітамінів. Інструментальні методи дослідження дозволяють виявити: 1) ознаки кардіомегалії; 2) зміни показників центральної гемодинаміки; 3) порушення ритму та провідності. На ЕКГ немає будь-яких характерних змін чи зрушення носять неспецифічний характер. Це ознаки збільшення розмірів серця, порушення провідності у вигляді блокади передньої гілки лівої ніжки передсердно-шлуночкового пучка (пучка Гіса) або повної блокади лівої ніжки (15% випадків); а також стійка синусова тахікардія (частота серцевих скорочень часто перевищує 100 ударів за 1 хв). Фонокардіограма підтверджує аускультативні дані у вигляді ритму галопу, досить частого виявлення шуму систоли (внаслідок відносної недостатності мітрального або тристулкового клапана). При застійних явищах у малому колі кровообігу виявляють акцент II тону. Рентгенологічно виявляються значне збільшення шлуночків (часто у поєднанні з помірним збільшенням лівого передсердя) та застій крові у легеневому (малому) колі кровообігу. Порушення у малому колі кровообігу проявляються посиленням легеневого судинного малюнка, а також появою транссудату у плевральних порожнинах, що утворюється внаслідок підвищення тиску в судинах легень. Метод ехокардіографії – один з основних у діагностиці захворювання. ЕхоКГ допомагає виявити дилатацію обох шлуночків, гіпокінезію задньої стінки лівого шлуночка, парадоксальний рух міжшлуночкової перегородки під час систоли. Крім цього, ЕхоКГ дозволяє уточнити збільшення амплітуди руху незмінених стулок мітрального клапана. Додаткові інструментальні дослідження не є обов'язковими для встановлення діагнозу, проте їх результати дозволяють деталізувати ступінь розладів гемодинаміки та характер морфологічних змін міокарда. Радіоізотопне дослідження серця (сцинтиграфія міокарда) проводиться для уточнення стану насосної функції серця, а також визначення зон загиблого міокарда. Дослідження показників центральної гемодинаміки виявляє низький хвилинний та ударний об'єм (хвилинний та ударний індекси), підвищення тиску в легеневій артерії. Ангіокардіографічно виявляються самі зміни, як і на ехокардіограмі. Прижиттєва біопсія міокарда неінформативна визначення етіології кардіоміопатії. У деяких випадках у біоптаті можна виявити вірусний антиген або збільшення вмісту ЛДГ, а також погіршення енергопродукції мітохондріями. Однак цей хірургічний метод можна використовувати для уточнення етіології захворювання та подальшої терапії. Маніпуляція проводиться наступним чином: під місцевим наркозом проколюють (пунктують) великі артерію та вену, потім по ходу до серця проводять спеціальний інструмент з маленькими ножицями на кінці. При поєднанні біопсії міокарда з коронароангіографією (введенням контрастної речовини в кровопостачальні серце коронарні артерії) з'являється можливість виключити у хворого на ІХС як одне із захворювань, яке має схожі з ДКМП симптоми. Ці два дослідження здійснюють під рентгенотелевізійним контролем. Диференціальна діагностика. Виробляється в першу чергу з міокардитом та міокардіодистрофіями, тобто з тими станами, які іноді необґрунтовано називаються вторинними кардіоміопатіями. Біопсія міокарда надає суттєву допомогу при диференціальній діагностиці дилатаційної кардіоміопатії та захворювань серця, що протікають із вираженим його збільшенням: 1) при тяжких дифузних міокардитах виявляється клітинна інфільтрація строми у поєднанні з дистрофічними та некротичними змінами кардіоміоцитів; 2) при первинному амілоїдозі, що протікає з ураженням серця (так званий кардіопатичний варіант первинного амілоїдозу), спостерігається значне відкладення амілоїду в інтерстиціальній тканині міокарда, що поєднується з атрофією м'язових волокон; 3) при гемохроматозі (захворюванні, обумовленому порушенням обміну заліза) у міокарді знаходять відкладення залізовмісного пігменту, спостерігаються різного ступеня дистрофія та атрофія м'язових волокон, розростання сполучної тканини. Як варіант ДКМП можна розглянути медикаментозні та токсичні кардіоміопатії. Численні агенти можуть викликати токсичні пошкодження міокарда: етанол, еметин, літій, кадмій, кобальт, миш'як, ізпротеренол та інші отрути. Патогістологічні зміни у тканинах серцевого м'яза проявляються у вигляді осередкових дистрофій. Надалі відбувається розвиток мікроінфарктів, що супроводжується периферичною запальною реакцією. Найяскравішим прикладом токсичної кардіоміопатії є кардіоміопатія, яка спостерігається у людей, які надмірно споживають пиво. Вона обумовлена наявністю в ньому кобальту, який додають у пиво для покращення пінності. Кобальт блокує дію вітаміну В1, і навіть безпосередньо впливає зміна ензимних процесів клітини. У гострій стадії перебігу кобальтової кардіоміопатії відзначаються наявність гідропічної та жирової дистрофії, деструкція внутрішньоклітинних органел, осередковий некроз кардіоміоцитів. Надалі відбувається розвиток дифузного або дрібноосередкового інтерстиціального фіброзу, заключним результатом є формування великих рубців. Кобальтова кардіоміопатія важча за алкогольну кардіоміопатію. Якщо постановка діагнозу відбувається вчасно, спостерігається клінічне лікування хворих. Алкогольна кардіоміопатія. Етанол надає прямий токсичний вплив на кардіоміоцити. До того ж, при хронічній етиловій інтоксикації часто спостерігається нестача харчування. Доведено, що алкоголь веде до комуляції в кардіоміоцитах жирних кислот, оскільки є нестача енергії, яка є необхідною для їхньої діяльності. Ацетальдегід, що утворюється при метаболізмі алкоголю, може бути фактором прямого токсичного на протеїновий синтез. Алкоголізм також супроводжується активацією латентних вірусів. Макроскопічно міокард в'ялий, глинистого вигляду, іноді спостерігаються маленькі рубчики. Коронарні артерії інтактні. При мікроскопічному дослідженні відзначається поєднання дистрофії (гідропічної та жирової), атрофії та гіпертрофії кардіоміоцитів, можлива наявність вогнищ лізису кардіоміоцитів та склерозу. Уражені ділянки міокарда контрастують із незміненими. При електронно-мікроскопічному дослідженні біоптатів серця спостерігається кістозне розширення саркоплазматичної мережі та Т-системи кардіоміоцитів, що є характерним для алкогольної кардіоміопатії. Ускладнення алкогольної кардіоміопатії – раптова смерть внаслідок фібриляції шлуночків або хронічна серцева недостатність, тромбоемболічний синдром. Лікування. Терапія кардіоміопатій є важким завданням, оскільки не відомі конкретні причини їх виникнення. Загальні принципи лікування ДКМП немає значних відмінностей від лікування хронічної серцевої недостатності. У випадках вторинної ДКМП додатково проводиться лікування попереднього захворювання (пороку клапана серця тощо), а також вживаються всіх заходів для усунення причин виникнення ДКМП. По суті, можна говорити про лікування хворих на кардіоміопатію лише при появі клінічних ознак. При серцевій недостатності серцеві глікозиди є малоефективними. У хворих швидко розвиваються явища непереносимості препаратів (глікозидна інтоксикація), у зв'язку з чим доводиться застосовувати глікозиди, які швидко виводяться з організму (строфантин, ізоланід). Досить ефективними є периферичні вазодилататори, особливо при супутньому ангінозному синдромі (нітронг, сустак, нітросорбід). Ці препарати слід призначати при вираженій серцевій недостатності, що погано піддається лікуванню глікозидами та сечогінними засобами. При ангінозному синдромі виникає необхідність застосовувати антиангінальні препарати, переважно пролонговані нітрати (сустак, нітронг, нітросорбід). Ефективними є адреноблокатори (їх призначають за відсутності ознак серцевої недостатності). Із сучасних методів хірургічного лікування ДКМП найефективнішим є пересадка (трансплантація) серця. Однак можливості проведення цієї операції суттєво обмежені. З цієї причини як альтернатива пересадці серця при сучасному лікуванні для збільшення тривалості життя хворим на ДКМП розроблені та проводяться реконструктивні операції, які спрямовані на ліквідацію недостатності мітрального та трикуспідального клапанів серця. Оперативне усунення недостатності цих клапанів дозволяє на якийсь час "загальмувати" настання кінцевої стадії захворювання. Ще однією альтернативою пересадці серця у хворих на ДКМП стало часткове видалення лівого шлуночка з метою зменшення його розмірів (операція Батиста). Нещодавно для лікування хворих на ДКМП були розроблені спеціальні моделі електрокардіостимуляторів, вони дозволяють зробити роботу шлуночків серця синхронною. Це призводить до покращення наповнення шлуночків серця кров'ю та збільшення насосної функції серця. Окремим питанням слід розглянути ДКМП у дітей, що становить 5-10 випадків на 100 000 дитячого населення на рік. Примітно, що хвороба може розвинутись у різних вікових груп, у тому числі у немовлят. Дані, отримані для дослідження групи дітей, такі: хворі отримували 3 варіанти терапії (монотерапія преднізолоном, монотерапія дигоксином або преднізолон + дигоксин). Ефективність лікування оцінювали за такими критеріями: визначали частоту серцевих скорочень до та після проведеного лікування, частоту дихання, стан фракції викиду та фракції скоротливості. Аналіз отриманих результатів свідчить, що найбільший ефект лікування дилатаційної кардіоміопатії у дітей раннього віку досягається за допомогою комбінації кортикостероїдів та глікозидів (преднізолону та дигоксину). Після завершення основного курсу лікування (Преднізолон призначають 2 мг/кг на день протягом 28 днів, дигоксин) спостерігалися виражене зниження частоти серцевих скорочень, зменшення задишки. На тлі монотерапії преднізолон відбувається зменшення частоти серцевих скорочень. Монотерапія дигоксином призводить до зменшення тахікардії та задишки. Враховуючи недоцільність призначення цитостатичних препаратів у дітей раннього віку, оскільки спостерігалася значна кількість ускладнень лікування, найбільш оптимальним у педіатрії є використання при дилатаційній кардіоміопатії серцевих глікозидів пролонгованої дії у поєднанні з кортикостероїдними гормонами. Профілактика. Профілактика ДКМП полягає у виключенні алкоголю, кокаїну, а також проведенні ретельного контролю показників серцевої діяльності при хіміотерапії пухлин. Корисно проводити загартовування організму з раннього віку. Повна відмова від вживання алкоголю при алкогольному різновиді ДКМП сприяє покращенню скорочувальної функції серця та може усунути необхідність його пересадки. До негативних результатів у лікуванні може призвести і той факт, що в більшості випадків захворювання на постановку діагнозу відбувається на стадії серцевої недостатності. Рання діагностика дилатаційної кардіоміопатії може проводитися при випадковій (скринінговій) ЕхоКГ, яка виконується при щорічній диспансеризації, а також при обстеженні осіб із обтяженою спадковістю за даним захворюванням. Саме у цьому випадку можливе підвищення ефективності медикаментозного лікування ДКМП. ЛЕКЦІЯ №3. Захворювання серцево-судинної системи. Гіпертрофічна кардіоміопатія Гіпертрофічна кардіоміопатія (ГКМП) - це некоронарогенне захворювання міокарда шлуночків (переважно лівого), що характеризується масивною гіпертрофією їх стінок з випинанням в порожнину правого шлуночка міжшлуночкової перегородки (МЖП), яка може бути значно потовщена. та порушенням розслаблення (діастолічною дисфункцією). Найчастіше зустрічається ізольована гіпертрофія міжшлуночкової перегородки (ізольований гіпертрофічний субаортальний стеноз – ІГСС) або апікальної частини шлуночків. Класифікація. Класифікація ГКМП з локалізації гіпертрофії (ED Wigle et al., 1985 з доповненнями). I. Гіпертрофія ЛШ. 1) Асиметрична гіпертрофія, при якій відбувається гіпертрофія міокарда окремих стінок або сегментів шлуночків (у тому числі гіпертрофія МЖП – 90 % з обструкцією вихідного тракту лівого шлуночка або без неї, середньошлуночкова – 1 %, апікальна гіпертрофія лівого шлуночка – 3 %, гіпертрофія вільної лівого шлуночка та задньої частини МЖП - 1%). 2) Симетрична (концентрична) гіпертрофія лівого шлуночка, коли гіпертрофія міокарда поширюється на всі стінки шлуночків, трапляється у 5 % випадків. ІІ. Гіпертрофія ПЗ. У тому випадку, коли гіпертрофія міокарда перешкоджає нормальному відтоку крові із шлуночків серця, говорять про обструктивну форму ГКМП. В інших випадках ГКМП є необструктивною. Етіологія. Захворювання може бути як уродженим, так і набутим. Вроджена ГКМП успадковується за аутосомно-домінантним типом. У межах однієї і тієї ж сім'ї можуть спостерігатися різні форми та варіанти ГКМП. Найчастіше успадковується асиметрична гіпертрофія міжшлуночкової перегородки. Набута форма ГКМП зустрічається у хворих похилого віку з артеріальною гіпертонією в анамнезі. Поширеність – 0,02-0,05 %. Причин розвитку набутих ДКМП до кінця не вивчені. Згідно з однією із запропонованих гіпотез у осіб із набутою ГКМП у внутрішньоутробному періоді відбувається формування дефекту адренергічних рецепторів серця, що беруть участь у регуляції серцевої діяльності, зокрема частоти серцевих скорочень. В результаті значно підвищується чутливість до норадреналіну та аналогічним йому гормонам, що збільшує частоту серцевих скорочень, що впливає на розвиток у них гіпертрофії міокарда, а згодом – і ГКМП. Патогістологічна картина. Дезорієнтоване, неправильне, хаотичне розташування кардіоміоцитів та міофібрил у кардіоміоцитах, фіброз міокарда – порушення архітектоніки серцевого м'яза. Патогенез. Розлади гемодинаміки виникають унаслідок порушення діастолічної функції серця. У період діастоли кров у шлуночки (особливо в лівий) надходить недостатньо через їх щільність і ригідність, що призводить до швидкого підйому кінцевого діастолічного тиску. І виражена жорсткість міокарда, і збільшений внутрішньошлуночковий тиск сприяють тому, що менший об'єм крові викидається зі шлуночка під час систоли. Для адекватної доставки кисню органам та тканинам організму (при нормальному функціонуванні серцево-судинної системи) для здійснення будь-яких навантажень викид крові із серця має збільшуватися. Відповідно у відповідь навантаження збільшується частота серцевих скорочень. При розвитку ГКМП наповнення кров'ю серця страждає й у спокої, а зі збільшенням частоти серцевих скорочень під час навантаження воно ще більше піддається негативному впливу. Внаслідок цього адекватного приросту насосної функції серця під час виконання навантаження при ГКМП не здійснюється. Фізичне навантаження при ГКМП впливає на підвищення внутрішньошлуночкового тиску, що веде до збільшення тиску в розташованому вище лівому передсерді, а також у судинах малого (легеневого) кола кровообігу. У цих умовах розвиваються гіперфункція та гіпертрофія лівого передсердя, а надалі - легенева гіпертензія ("пасивна"). В результаті виникає задишка, яка має пропорційну залежність від рівня навантаження. Так як під час фізичного навантаження викид крові з лівого шлуночка не відповідає приросту навантаження, спочатку починає страждати кровотік у вінцевих артеріях, що живлять самий серцевий м'яз. Відіграє важливу роль і той факт, що при ГКМП виникає невідповідність між значною масою гіпертрофованого міокарда та можливістю коронарного кровопостачання, що залишається таким самим, як у здорових людей. Зниження кровотоку по вінцевих артеріях призводить до виникнення стенокардіческіх болів посередині і в лівій половині грудної клітки, що іррадіюють у ліву руку, під ліву лопатку. Як і задишку, стенокардію провокує фізичне навантаження. У деяких випадках ГКМП при навантаженні також погіршується і церебральне кровопостачання, у результаті виникають непритомність. Необхідно відзначити, що для зниження зростання внутрішньошлуночкового тиску під час навантаження існує компенсаторний механізм, робота якого заснована на тому, що порожнина лівого передсердя розширюється, а товщина стінок його збільшується. Як наслідок відбувається додаткове наповнення лівого шлуночка кров'ю при навантаженні. Однак це лише тимчасова компенсація внаслідок того, що резерв лівого передсердя як насоса незначний, а значне розширення порожнини лівого передсердя веде до розвитку миготливої аритмії. клінічна картина. Для ГКМП характерна надзвичайна різноманітність симптомів, що є причиною помилкової діагностики. Наявність та строки появи скарг при ГКМП в основному визначаються 2 факторами: формою ГКМП та локалізацією ураження. Найпотужнішою камерою серця є лівий шлуночок, тому при гіпертрофії міокарда його стінок скарги можуть не виявлятися тривалий час. Ізольована поразка правого шлуночка серця зустрічається вкрай рідко. При необструктивній формі ГКМП, коли відтоку крові зі шлуночка нічого не заважає, пацієнт може не скаржитися. Іноді можуть відзначатись задишка (при значному фізичному навантаженні), перебої в роботі серця, а також неритмічне серцебиття. При обструктивній формі ГКМП значно знижується викид крові із серця під час фізичного навантаження через наявність перешкоди відтоку крові із шлуночка. У такому разі типовими скаргами стають задишка при фізичному навантаженні, стенокардія та непритомні стани. Для захворювання характерним є повільне прогресування скарг з моменту своєї появи. Внаслідок подібності скарг (болі в ділянці серця та за грудиною) та даних дослідження (інтенсивний систолічний шум) найбільш часто ставлять помилковий діагноз ревматичної вади серця та ішемічної хвороби серця. Клінічну картину ГКМП становлять: 1) ознаки гіпертрофії міокарда шлуночків (переважно лівого); 2) ознака недостатньої діастолічної функції шлуночків; 3) варіабельні ознаки обструкцій вихідного тракту лівого желудочка. Діагностика. У процесі діагностичного пошуку найбільш істотним є виявлення шуму систоли, зміненого пульсу і зміщеного верхівкового поштовху. Аускультативна картина серця у хворих з обструктивною формою ГКМП має ряд особливостей: максимум звучання систолічного шуму (шум вигнання) визначається в точці Боткіна і на верхівці серця, вираженість шуму пропорційна ступеню обструкції, його посилення відбувається при різкому вставанні хворого, а також при проведенні проби Вальсаль ; II тон завжди збережений; шум не проводиться на судини шиї. Пульс найчастіше високий, швидкий. Це пояснюється відсутністю звуження на шляхах відтоку з лівого шлуночка на початку систоли, але потім скорочення потужної мускулатури з'являється "функціональне" звуження шляхів відтоку, внаслідок чого пульсова хвиля знижується передчасно. Верхівковий поштовх приблизно в 1/3 випадків має подвійний характер: спочатку при пальпації відчувається удар від скорочення лівого передсердя, потім від скорочення лівого шлуночка. Для зручності виявлення цієї властивості верхівкового поштовху краще проводити пальпацію в положенні хворого лежачи на лівому боці. Для діагностики ГКМП найбільше значення мають дані ехокардіографії, що дозволяють уточнити анатомічні особливості захворювання, ступінь гіпертрофії міокарда, обструкцію вивідного тракту лівого шлуночка. Виявляються такі ознаки: асиметрична гіпертрофія МЖП, більш виражена у верхній третині, її гіпокінез; систолічний рух передньої стулки мітрального клапана у напрямку допереду; зіткнення передньої стулки мітрального клапана з МЖП діастолу. Неспецифічними ознаками є гіпертрофія лівого передсердя, гіпертрофія задньої стінки лівого шлуночка, зменшення середньої швидкості діастолічного прикриття передньої стулки мітрального клапана. На ЕКГ якісь специфічні зміни виявляються лише за досить розвиненої гіпертрофії лівого желудочка. За допомогою запису ЕКГ протягом 24 годин (холтерівське моніторування) виявляються наявні порушення ритму серця. ЕКГ-проба з дозованим фізичним навантаженням за допомогою велоергометра або тредмілу дозволяє оцінити вираженість симптомів захворювання, його прогноз та розробити відповідне лікування. Ізольована гіпертрофія МШП обумовлює збільшення амплітуди зубця Q у лівих грудних відведеннях (V5-6), що ускладнює диференціальну діагностику з осередковими змінами внаслідок перенесеного інфаркту міокарда. Однак виключити перенесений інфаркт міокарда дозволяє невелика ширина зубця Q. У процесі розвитку гемодинамічного навантаження лівого передсердя на ЕКГ можуть спостерігатися ознаки гіпертрофії лівого передсердя: розширення зубця Р більше 0,10 с, збільшення його амплітуди, поява двофазного зубця Р1 зі збільшеною за амплітудою та тривалістю другою фазою. Рентгенодіагностика має значення лише в розвиненій стадії хвороби, коли можуть визначатися збільшення лівого шлуночка і лівого передсердя, розширення частини аорти, що сходить. На фонокардіограмі амплітуди І та ІІ тонів збережені, що є диференціальною ознакою ГКМП від стенозу гирла аорти, а також виявляється систолічний шум різного ступеня вираженості. Інвазивні методи дослідження (зондування лівих відділів серця, контрастна ангіографія) нині є обов'язковими, оскільки ехокардіографія дає цілком достовірну для встановлення діагнозу інформацію. Однак іноді ці методи використовують у спірних випадках для уточнення діагнозу або під час підготовки хворих до оперативного втручання. Застосовується зондування серця під рентгенотелевізійним контролем. Техніка виконання методу: шляхом пункції великої артерії під місцевою анестезією з подальшим введенням спеціального катетера в порожнину серця вимірюють градієнт (різницю) тиску між лівим шлуночком і аортою, що відходить від нього. У нормі цього градієнта не повинно бути. Однак при ГКМП виявляється наявність різниці тиску між лівим шлуночком та аортою від 50 до 150 мм рт. ст., збільшення кінцевого діастолічного тиску у порожнині лівого шлуночка до 18 мм рт. ст. Градієнт тиску зменшується після введення β-адреноблокаторів. Також під час зондування серця вводиться контрастна речовина у порожнину шлуночка (вентрикулографія) для дослідження його анатомічної особливості. У ряду хворих (як правило, це особи старше 40 років) перед операцією на серці одночасно використовують ангіографію коронарних артерій (коронароангіографію) для уточнення етіології стенокардії та виключення супутньої ІХС. Лікування. В основі медикаментозного лікування ГКМП лежать лікарські засоби, що покращують кровонаповнення шлуночків серця у діастолу. Цими препаратами є група β-адреноблокаторів (анаприлін, атенолол, метопролол та пропранолол, 160-320 мг/добу та ін.) та група антагоністів іонів кальцію (верапаміл, але з обережністю). Новокінамід та дизопірамід також зменшують частоту серцевих скорочень та мають протиаритмічний ефект. На початку лікування застосовують малі дози цих препаратів, потім відбувається поступове збільшення дозування до максимально переносимої хворим. β-адреноблокатори застосовують з обережністю при цукровому діабеті, бронхіальній астмі та деяких інших захворюваннях. При лікуванні цими препаратами потрібен постійний контроль рівня артеріального тиску та частоти пульсу. Небезпечним є зниження тиску нижче 90/60 мм рт. ст. та частоти пульсу нижче 55 за хвилину. Якщо у хворого виявляються небезпечні порушення ритму, які не піддаються лікуванню β-адреноблокаторами або антагоністами іонів кальцію, то при лікуванні хворих додатково використовуються інші антиаритмічні препарати. Призначення антикоагулянтів рекомендується при пароксизмальних аритміях та миготливих артіміях, а також за наявності тромбів у камерах серця (варфарин та ін.). У період лікування цими препаратами необхідно регулярно проводити контроль ряду показників системи згортання крові. При значному передозуванні антикоагулянтів можливі зовнішні (носові, маткові та ін.) та внутрішні кровотечі (гематоми та ін.). Хірургічне лікування проводиться хворим з обструктивною формою ГКМП у тому випадку, коли медикаментозне лікування не є ефективним або при рівні градієнта між лівим шлуночком та аортою понад 30 мм рт. ст. (Здійснюється операція міотомії або міоектомії - висічення або видалення частини гіпертрофованого міокарда лівого шлуночка). Також проводять протезування мітрального клапана та нехірургічну абляцію МЖП. Профілактика. Всім хворим на ГКМП, особливо з обструктивною формою, протипоказані заняття такими видами спорту, при яких можливе виражене збільшення фізичного навантаження за невеликий проміжок часу (легка атлетика, футбол, хокей). Профілактика захворювання полягає в ранній діагностиці, що дає можливість розпочати раннє лікування хвороби та запобігти розвитку вираженої гіпертрофії міокарда. Обов'язкове виконання ЕхоКГ у генетичних родичів хворого. Важливі для діагностики та скринінгові ЕКГ та ЕхоКГ, які проводяться при щорічній диспансеризації. У пацієнтів з обструктивною формою ГКМП необхідно проводити профілактику інфекційного ендокардиту (антибіотикопрофілактика тощо), оскільки наявність обструкції створює умови для розвитку цього загрозливого життя стану. ЛЕКЦІЯ №4. Захворювання серцево-судинної системи. Рестриктивна кардіоміопатія Рестриктивна кардіоміопатія (РКМП) - (від лат. слова restrictio - "обмеження") - група захворювань міокарда та ендокарда, при яких внаслідок різко вираженого фіброзу та втрати еластичності, зумовленими різними причинами, відбувається фіксоване обмеження заповнення шлуночків у діастолу. Наповнення шлуночків здійснюється у фазу раннього наповнення з подальшою стабілізацією внутрішньошлуночкового тиску. Захворювання супроводжується недостатнім кровонаповненням серця, що надалі призводить до розвитку хронічної серцевої недостатності. Рестриктивна кардіоміопатія – найменш вивчена та найменш поширена з усіх кардіоміопатій. До РКМП належать: лефлерівський парієтальний фібропластичний ендокардит (зустрічається в країнах з помірним кліматом, описаний W. Loffler та ін., 1936) і ендоміокардіальний фіброз (зустрічається в країнах тропічної Африки, описаний D. Bedford et E. Konstman). Раніше вони розглядалися як два самостійні патологічні процеси. Проте патоморфологічна картина за цих захворюваннях мало відрізняється. Причини виникнення РКМП. Первинна РКМП зустрічається дуже рідко, і єдиною доведеною причиною її виникнення є так званий гіпереозинофільний синдром (хвороба Леффлера, лефлерівський парієтальний фібропластичний ендокардит). Зустрічається переважно у чоловіків віком 30-40 років. При гіпереозинофільному синдромі відбувається запалення ендокарда, що згодом завершується значним ущільненням ендокарда і грубим його спаянням з розташованим поруч міокардом, що веде до різкого зниження розтяжності серцевого м'яза. Для лефлерівського синдрому також характерні персистуюча протягом 6 місяців і більше еозинофілія (1500 еозинофілів в 1 мм.)3), ураження внутрішніх органів (печінки, нирок, легенів, кісткового мозку). У переважній більшості випадків походження РКМП є вторинним, зумовленим іншими причинами, серед яких найчастішими є: 1) амілоїдоз – захворювання, пов'язане з порушенням білкового обміну в організмі; при цьому в тканинах різних органів утворюється та відкладається у великій кількості аномальний білок (амілоїд); при ураженні серця амілоїд викликає зниження його скоротливості та розтяжності; 2) гемохроматоз - порушення обміну заліза в організмі, що супроводжується підвищеним вмістом заліза в крові, його надлишок відкладається в багатьох органах і тканинах, у тому числі і в міокарді, викликаючи цим зниження його розтяжності; 3) саркоїдоз - захворювання невідомої етіології, що характеризується утворенням в органах і тканинах клітинних скупчень (гранулем); найчастіше уражаються легені, печінка, лімфовузли та селезінка; а гранульоми, що розвиваються, в міокарді призводять до зниження його розтяжності; 4) захворювання ендокарда (ендокардіальний фіброз, фіброеластоз ендокарда та ін), коли спостерігається значне потовщення та ущільнення ендокарда, що також призводить до різкого обмеження розтяжності міокарда. Фіброеластоз ендокарда, зокрема, може зустрічатися лише у немовлят; ця хвороба не є сумісною із життям через ранній розвиток вираженої серцевої недостатності. Патогенез. При РКМП через різні причини страждає розтяжність міокарда. Внаслідок цього знижується наповнення шлуночків кров'ю, значно підвищується внутрішньошлуночковий тиск. Проте, на відміну ГКМП, можливість розвитку компенсаторної гіпертрофії міокарда при рестриктивної кардіоміопатії невелика. Таким чином, через якийсь час відбувається застій у легеневому колі кровообігу та знижується насосна функція серця, що призводить до поступової затримки рідини в організмі, розвитку стійких набряків ніг, гепатомегалії та асциту. Якщо ущільнення ендокарда поширюється на передсердношлуночкові клапани (мітральний і трикуспідальний), це посилюється розвитком їх недостатності, а також призводить до тромборозрізання в порожнинах серця через їхню знижену скоротливість і розтяжність. Поширення фрагментів цих тромбів із кровотоком може викликати тромбоемболію та закупорку великих судин, інфаркти внутрішніх органів. При поширенні патологічних включень міокарда на зону системи серця, що проводить, можуть з'являтися різноманітні порушення провідності серцевого імпульсу, що супроводжуються розвитком блокад. При РКМП також часто спостерігаються різні види аритмій. З вищепереліченого можна дійти невтішного висновку у тому, що захворювання з патогенетичної погляду протікає в 3 стадії. I стадія – некротична – еозинофільна інфільтрація міокарда та інших органів. ІІ стадія – тромботична – утворення тромбів у порожнинах лівого та правого шлуночків, розвиток тромбоемболічних ускладнень та поступове потовщення ендокарда переважно в апікальних областях та поблизу атріовентрикулярних клапанів. III стадія – фіброзна, що характеризується потовщенням ендокарда до кількох міліметрів, виражений фіброз міокарда – переважно субендокардіальних ділянок. Порожнину частково облітеровано за рахунок організованих тромбів, відзначаються фіброз стулок мітрального клапана, мітральна регургітація. Виражено дилатацію передсердь. Спостерігається діастолічна дисфункція за рестриктивним типом. клінічна картина. Прояви хвороби надзвичайно поліморфні та визначаються симптомами порушення кровообігу у малому чи великому колі (залежно від переважного ураження правого чи лівого шлуночків). Скарги можуть бути відсутніми або обумовлені застійними явищами в малому або великому колі кровообігу. Хворі зазвичай скаржаться на задишку, яка спочатку з'являється при фізичному навантаженні, а з розвитком захворювання задишка спостерігається і в спокої. Через зниження насосної функції серця хворий скаржиться на швидку стомлюваність та погану переносимість будь-якого навантаження. Згодом приєднуються набряки ніг, збільшення печінки та водянка живота. Періодично з'являється неритмічне серцебиття, а при розвитку стійких блокад можуть бути непритомні стани. Перша стадія розвитку захворювання (некротична) характеризується появою лихоманки, втратою ваги, кашлем, висипанням шкіри та тахікардією. Діагностика. Розпізнавання РКМП дуже важко. З упевненістю про цю патологію можна говорити тільки після виключення низки схожих захворювань (таких як ідіопатичний міокардит типу Абрамова-Фідлера, ексудативний перикардит, клапанні вади серця). При огляді хворих на РКМП виявляються характерні для застійної серцевої недостатності симптоми (набряки, гепатомегалія та асцит), а також виражена пульсація вен шиї. Останнє зумовлено утрудненням надходження крові до серця через погану розтяжність міокарда. При аускультації велике значення набуває виявлення збільшення серця, м'якого пізнього систолічного шуму та гучного раннього III тону (зумовленого швидким наповненням шлуночків під час діастоли). Шуми в серці також виявляються у хворих з недостатністю передсердно-шлуночкових клапанів. При ЕКГ-дослідженні виявляються помірна гіпертрофія міокарда шлуночків, а також різні порушення ритму та провідності серцевого імпульсу, неспецифічні зміни зубця Т на ЕКГ. ЕхоКГ-дослідження є одним із найбільш інформативних методів діагностики захворювання, з його допомогою виявляються потовщення ендокарда, зміна характеру наповнення шлуночків серця, зниження насосної функції серця, швидкий рух передньої стулки мітрального клапана в період діастоли та швидкий ранній рух задньої стінки лівого шлуночка назовні. Магніторезонансна томографія дозволяє отримати інформацію про анатомію серця, визначити патологічні включення до міокарда та виміряти товщину ендокарда. При дослідженні параметрів центральної гемодинаміки визначається підвищений тиск заповнення в обох шлуночках, причому кінцевий тиск у лівому перевищує аналогічний показник у правому шлуночку. Вентрикулографія виявляє посилення скорочення лівого шлуночка, гладкі контури його стінок, іноді з дефектом заповнення області верхівки (свідчення облітерації). У деяких випадках визначаються вдавлення в ділянці сосочкових м'язів. Спостерігаються ознаки клапанної недостатності, зокрема мітрального чи тристулкового клапана. Диференціальна діагностика. При диференціальній діагностиці РКМП дуже важливо враховувати схожість захворювання на зовнішні прояви з констриктивним перикардитом, але методика лікування при цих захворюваннях діаметрально протилежна. Прижиттєва біопсія міокарда і ендокарда зазвичай застосовується одночасно з зондуванням серця, що дозволяє мати більшу інформативність для уточнення природи захворювання і проведення подальшого лікування. У вкрай поодиноких випадках, коли перераховані вище методи діагностики не дозволяють відрізнити РКМП від констриктивного перикардиту, проводять безпосередню ревізію перикарда на операційному столі. Всім хворим на РКМП необхідно проведення всебічного клініко-біохімічного та додаткового обстеження для визначення позасерцевих причин захворювання. Лікування. Лікування захворювання становить значні труднощі. Більшість лікарських засобів, які використовуються для лікування серцевої недостатності, можуть не приносити бажаних результатів у зв'язку з тим, що внаслідок особливостей захворювання неможливо отримати значне поліпшення розтяжності міокарда (у деяких випадках для цього призначають антагоністи іонів кальцію). Використовуються сечогінні препарати (альдактон) для усунення надлишку рідини в організмі. Для ліквідації стійких порушень провідності може виникнути потреба у постановці (імплантації) постійного електрокардіостимулятора. До цього призводять такі захворювання, як саркоїдоз та гемохроматоз, що призводять до розвитку вторинних РКМП, вони підлягають самостійному лікуванню. При лікуванні саркоїдозу використовують гормональні препарати (преднізолон та ін), а при гемохроматозі – регулярні кровопускання (для зниження концентрації заліза в організмі). Лікування амілоїдозу міокарда має пряму залежність від причин виникнення. Доцільним є застосування антикоагулянтних препаратів при тромбоутворенні в камерах серця. До хірургічного лікування вдаються у випадках РКМП, спричинених ураженням ендокарда. У ході операції по можливості січуть частину ендокарда, що зазнала змін. У деяких випадках, якщо є недостатність передсердно-шлуночкових клапанів, відбувається їх протезування. Лікування деяких форм амілоїдного ураження міокарда здійснюється за допомогою пересадки серця. Профілактика РКМП. На жаль, профілактичні заходи при цьому захворюванні обмежені. Головним чином, необхідно раннє виявлення потенційно усунутих причин амілоїдозу, саркоїдозу, гемохроматозу та ін. Для досягнення цих цілей велике значення має проведення щорічної диспансеризації населення. Лекція № 5. Захворювання серцево-судинної системи. Інфекційний ендокадит Інфекційний ендокардит (ІЕ) - захворювання, що полягає у поліпозно-виразковому ураженні клапанного апарату серця (нерідко з розвитком клапанної недостатності) або пристінкового ендокарда (рідше уражається ендотелій аорти або найближчої великої артерії). Викликається захворювання на різні патогенні мікроорганізми і супроводжується системним ураженням внутрішніх органів (нирок, печінки, селезінки) на тлі зміненої реактивності організму. Досі в різних друкованих виданнях можна зустріти терміни, що раніше використовувалися, "бактеріальний ендокардит", "затяжний септичний ендокардит" для позначення даного патологічного процесу. Однак саме термін "інфекційний ендокардит", що витіснив їх, краще відображає причину захворювання, що викликається різними мікроорганізмами - бактеріальними агентами, рикетсіями, вірусами і грибами. У всьому світі збільшується чисельність хворих на ІЕ. Це пов'язано з наявністю так званих груп ризику (пацієнти з атеросклеротичними, ревматичними, травматичними ушкодженнями клапанів, з вадами серця або клапанів, дефектом міжшлуночкової перегородки, коарктацією аорти) як наслідок того, що інфекція легше виникає на патологічно зміненому клапані або ендокарді. Етіологія. Патогенними збудниками хвороби найчастіше є кокова група мікроорганізмів - стрептококи (зелений стрептококи раніше виділялися в 90% випадків), стафілококи (золотистий, білий), ентерокок, пневмокок. В останні роки у зв'язку з широким використанням антибіотиків спектр мікробних збудників став іншим. Хворобу може викликати грамнегативна флора (кишкова паличка, синьогнійна паличка, протей, клебсієла), з'явилися дані про важливу роль патогенних грибів, сарцин, бруцел і вірусів. Захворювання, спричинені цими збудниками, протікають важче, особливо ендокардит, спричинений грибковою інфекцією (виникає, як правило, у зв'язку з нераціональним прийомом антибіотиків). Однак у ряду хворих справжній збудник захворювання не виявляється (частота негативного результату посіву крові 20-50%). Часто інфекція виникає на місці протезованого клапана - так званий протезний ІЕ, що розвивається переважно протягом 2 місяців після оперативного втручання з протезування клапана серця. У цьому випадку збудник захворювання найчастіше має стрептококову природу. Таким чином, джерела інфекції та бактеріємії при ІЕ найрізноманітніші (операції в ротовій порожнині, операції та діагностичні процедури в сечостатевій сфері, оперативне втручання на серцево-судинній системі (у тому числі протезування клапанів), тривале перебування катетера у вені, часті внутрішньовенні вливання та ендоскопічні методи дослідження, хронічний гемодіаліз (артеріовенозний шунт), внутрішньовенне введення наркотиків). Виділяють так званий первинний ІЕ, що розвинувся на інтактних клапанах, а також ІЕ на тлі вроджених та набутих змін серця та його клапанного апарату – вторинний ендокардит. Ці зміни і дозволяють виділяти пацієнтів в окремі групи ризику: вади серця (вроджені та набуті), пролапс мітрального клапана, артеріовенозні аневризми, постінфарктні аневризми, шунти, стан після операції на серці та великих судинах. Патогенез. Механізм розвитку ІЕ складний та вивчений недостатньо, проте можна виділити основні моменти у розвитку захворювання. За наявності в організмі вогнища інфекції під впливом зміненого гуморального та місцевого (клітинного) імунітету із збоченням імунологічних реакцій, різних ендогенних та екзогенних факторів розвивається бактеріємія. З крові мікроорганізми потрапляють на клапани серця, створюючи там вторинний осередок інфекції. Фіксації та розмноженню мікроорганізмів на ендокарді сприяє ряд факторів: попередня зміна тканини та поверхні клапана, наявність на ньому тромботичних мас, що виникають під впливом прямої ушкоджуючої дії струменя крові при зміні її внутрішньосерцевої циркуляції в умовах наявної вади серця. При цьому до місця травматичного пошкодження "приклеюються" різні клітини крові (тромбоцити та ін), утворюючи клітинні розростання, що нагадують бурульки, що звисають із клапана. Ці вегетації стають доступними для інфекції, що потрапила до судинного русла. Деформація клапанів внаслідок виникнення великого градієнта тиску, вузькості отвору та зміни швидкості кровотоку також сприяє впровадженню інфекційних агентів у ендокард із утворенням інфекційного вогнища. При ураженні раніше інтактного клапана відбуваються зміни, що порушують нормальні властивості окремих ділянок цього клапана (з'являється набряклість), ексудативних або проліферативних процесів (інтерстиціальний вальвуліт - доклінічна фаза). У розвитку захворювання можна назвати III стадії. І стадія (інфекційно-токсична) протікає з різним ступенем виразності інтоксикації. Відбувається зростання бактерій, руйнування клапанів, що веде до розвитку вад серця; у цій же стадії часто відбувається генералізація процесу за рахунок гематогенного поширення інфекції - від клапана можуть відокремлюватися шматочки стулок або колоній мікроорганізмів, стулки можуть розриватися. Відрив шматочків клапанних мікробних вегетацій сприяє занесення інфікованих емболів у різні ділянки судинного русла та посилює септичні прояви. Шматочки клапана або мікробних вегетацій циркулюють по організму зі струмом крові, при попаданні в мозок викликають інфаркти мозку, які супроводжуються паралічами, парезами та іншими різними неврологічними порушеннями. Клапан, що зазнав руйнувань, не може виконувати свою функцію, і незабаром виникає серцева недостатність, що блискавично розвивається. ІІ стадія – імунозапальна, при якій фіксовані на клапанах мікроорганізми викликають тривалу аутосенсибілізацію та гіперергічне пошкодження органів та тканин організму (імуна генералізація процесу). У цей період циркулюють у крові та фіксуються у тканинах (серце, нирках, печінці, судинах) імунні комплекси. Імунні та аутоімунні порушення зумовлюють розвиток васкулітів та вісцеритів (імунокомплексний нефрит, міокардит, гепатит, капілярит тощо). III стадія – дистрофічна – виникає при прогресуванні патологічного процесу: функції низки органів порушуються, виникає серцева та ниркова недостатність, що ще більше посилює перебіг захворювання. Класифікація. В даний час використовуються класифікація та номенклатура ІЕ, що відображають клінічну форму, варіант перебігу, ступінь активності, патогенетичну фазу та клініко-морфологічну форму хвороби (див. табл. 6). Таблиця 6 Класифікація ІЕ
Також розрізняють активний та неактивний (загоюваний) ІЕ. Існує і хірургічна класифікація, у якій виділяють: 1) ураження обмежується стулками клапана; 2) ураження поширюється межі клапана. Гострий ІЕ (швидкопрогресуючий, розвивається протягом 8-10 тижнів) зустрічається рідко, як правило, у осіб, які раніше не мали ураження серця, і клінічно проявляється картиною загального сепсису. При сучасних методах лікування вдається перевести його в підгострий. Підгострий ІЕ (зустрічається найчастіше) триває 3-4 місяці, при адекватній медикаментозній терапії може настати ремісія. Проте можливі рецидиви хвороби. Затяжний ІЕ триває багато місяців з періодами загострення та ремісій, для нього характерні неяскраві клінічні прояви, незначні лабораторні показники та порушення загального стану. Захворювання зазвичай добре піддається лікуванню. При несприятливому перебігу виникають важкі ускладнення, і хворі гинуть від серцевої недостатності, що прогресує, наростаючої септичної інтоксикації. клінічна картина. Залежно від збудника інфекції ІЕ може виникати раптово і бурхливо розвиватися (золотистий стафілокок, ентерококи) або мати прихований початок (зелений стрептокок). Прояви ІЕ представлені як синдромів. 1) Синдром запальних змін та септицемії (лихоманка, озноб, геморагічні висипання, зміна острофазових показників крові: лейкоцитоз зі зсувом вліво, збільшення ШОЕ, поява С-реактивного білка, підвищення вмісту фібриногену, α2-глобулінів. 2) Синдром загальної інтоксикації організму (слабкість, пітливість, головний біль, міалгії та артралгії, зниження апетиту, блідість шкірних покривів з жовтяничним відтінком). 3) Синдром ураження клапанів (формування вад серця). 4) Синдром "лабораторних" імунних порушень (наявність імунних комплексів, що циркулюють у крові або фіксованих у нирках, міокарді, судинах; гіпергаммаглобулінемія; поява ревматоїдного фактора; виявлення протитканинних антитіл). 5) Синдром тромбоемболічних ускладнень (вогнищевий нефрит, інфаркт міокарда, селезінки, кишечника, тромбоемболії у мозок, судини нижніх кінцівок тощо). 6) Синдром генералізації уражень (дифузний гломерулонефрит, міокардит, гепатит, васкуліт тощо). Ступінь вираженості зазначених синдромів різна. Вона залежить від характеру перебігу ІЕ, стадії, виду збудника. Наприклад, для стафілококового ІЕ характерні висока активність процесу, тяжкі симптоми загальної інтоксикації, розвиток гнійних ускладнень. Грибкові ендокардити, як правило, супроводжуються емболічною оклюзією великих артерій, особливо нижніх кінцівок. Типова картина захворювання характерна для ІЕ, викликаного зеленим стрептококом. Початок захворювання часто пов'язаний із гострою інфекцією або загостренням хронічної інфекції, а також із низкою лікарських маніпуляцій. Особливо характерне поєднання підвищення температури тіла різного ступеня (від тривалої лихоманки до субфебрилітету або нормальної температури) з ознобами та пітливістю. Хворий подає одночасні скарги, зумовлені наявністю інфекційного процесу та інтоксикації, а також тромбоемболічними ускладненнями ураженням серця. В анамнезі хворих можуть бути епізоди тривалого лікування антибіотиками (це буває при рецидиві ІЕ у хворих, які раніше вже піддавалися лікуванню). Діагностика. Найбільше значення для постановки правильного діагнозу має виявлення ураження клапанів серця щодо зміни аускультативної картини раніше існуючих вад серця; поява "додаткових" шумів. Виявляються характерні ураження шкіри та слизових оболонок: колір шкірних покривів "кава з молоком", геморагії, позитивні симптоми Гехта (щипка) та Кончаловського-Румпеля-Леєде (джгута), а також вузлики Ослера - болючі гіперемовані щільні вузлики на долонній поверхні та , ознака Лукіна-Лібмана (плями Лукіна) - геморагія на перехідній складці кон'юнктиви Часто спостерігаєте при ІЕ спленомегалію. Дуже типова значна втрата у вазі (іноді на 15-20 кг). У поодиноких випадках розвивається перикардит (нерізкий шум тертя плеври, зумовлений фібринозними накладеннями на перикарді). При фізикальному обстеженні можна виявити підвищення артеріального тиску, що вказує на розвиток дифузного гломерулонефриту. Іноді визначаються ознаки порушення діяльності центральної нервової системи (парези, гіперкінези, патологічні рефлекси тощо) в результаті емболії мозкових судин. В даному випадку найчастішою діагностичною помилкою є оцінка того чи іншого синдрому як прояв самостійного захворювання (наприклад, при виражених ознаках ураження печінки ставлять діагноз гепатиту тощо). Однак діагностика ІЕ заснована насамперед на ранньому виявленні збудника захворювання. І тому використовуються такі лабораторно-инструментальные дослідження. 1) Отримання позитивної гемокультури – найважливіша діагностична ознака ІЕ. Аналіз також необхідний для вибору найбільш ефективного в даному випадку антибіотика. Для підтвердження діагнозу їх потрібно щонайменше 2-3. Велике значення мають техніка забору та посіву крові, час посіву (бажано на висоті лихоманки), використання збагачених середовищ. 2) Проведення НБТ (нітроблуттетразоліум тесту) – діагностикума системних бактеріальних інфекцій, що дозволяє диференціювати бактеріальні інфекції від інших запальних захворювань. Метод заснований на відновленні нейтрофілами розчинної фарби НБТ у нерозчинний преципітат формазану. При кількості НБТ-позитивних клітин понад 10% тест вважається позитивним. 3) Клінічний аналіз крові для виявлення острофазових показників: підвищення ШОЕ до 50 мм/год і більше, лейкоцитоз зі зсувом лейкоцитарної формули вліво або (у II стадії) можуть виявлятися лейкопенія та гіпохромна анемія. Діагностичне значення надається виявленню гістіоцитів у крові, взятій із мочки вуха. Зміст їх понад 6 у зору може свідчити на користь ИЭ. Біохімічний аналіз крові показує збільшення вмісту фібриногену, α2-глобулінів та α-глобулінів - до 30-40%. 4) Виявлення імунологічних зрушень: гіпергаммаглобулінемія, циркулюючі імунні комплекси, зниження титру комплементу, поява ревматоїдного (антиглобулінового) фактора, посилення реакції владної трансформації лімфоцитів з ФГА (фітогемагглютинін), антибактеріальними антитілками. 5) Аналіз сечі проводиться для уточнення уражень різних органів та систем, коли виявляється гломерулонефрит, що проявляється протеїнурією, циліндрурією та гематурією. Підвищення вмісту білірубіну, трансаміназ свідчить про ураження печінки. 6) Пряма діагностична ознака ІЕ – наявність вегетації на клапанах серця – виявляється при ехокардіографії. Таким чином, із усього різноманіття симптомів слід виділяти основні та додаткові. Основні критерії діагнозу ІЕ: 1) лихоманка з температурою понад 38 ° C з ознобами; 2) плями Лукіна; 3) вузлики Ослера; 4) ендокардит на незмінених клапанах (первинний) або на тлі ревматичних та вроджених вад серця. Інфекційний міокардит; 5) множинні артеріальні тромбоемболії, розриви мікотичних аневризм із крововиливами; 6) спленомегалія; 7) позитивна гемокультура; 8) виражений позитивний ефект застосування антибіотиків. Додаткові критерії діагнозу ІЕ: 1) підвищення температури тіла до 38 ° C, познабування; 2) геморагії на шкірі; 3) швидке схуднення; 4) асиметричний артрит дрібних суглобів кистей рук, стоп; 5) анемізація; 6) ШОЕ понад 40 мм/год; 7) різко позитивний СРВ; 8) наявність ревматоїдного фактора; 9) α-глобуліни вище 25%; 10) підвищення вмісту імуноглобулінів М, Е та А. Диференціальна діагностика. Хоча тромбоемболії найчастіше спостерігаються при ІЕ, не слід виключати інші причини емболії в артерії великого кола кровообігу: трансмуральний інфаркт міокарда та аневризму серця, ідіопатичний міокардит Абрамова-Фідлера і миготлива аритмія різного походження, але передусім спостерігається при . Найбільше значення для диференціальної діагностики мають ревматичний та інфекційний ендокардити (табл. 7). Таблиця 7 Диференціально-діагностичні критерії ревматичного ендокардиту та затяжного ІЕ
До характерних симптомів ІЕ відноситься збільшення селезінки. Однак велика щільна безболісна селезінка спостерігається при амілоїдозі; м'яка, безболісна вказує на її септичну гіперплазію. Болючість відзначається при інфаркті селезінки, що міститься субкапсулярно. Спленомегалія може бути одним із проявів портальної гіпертензії при недостатності правого серця. У цьому випадку вона поєднується з асцитом та гепатомегалією. Збільшення розмірів печінки при затяжному ІЕ спостерігається досить часто. Септична гіперплазія характеризується відносно невеликим збільшенням та м'якою консистенцією печінки. Зустрічаються жирова дистрофія і рідко - інфаркти печінки. Найчастіше збільшення печінки пов'язані з венозним застоєм при недостатності правого серця. За відсутності асциту застій розпізнається ретроспективно щодо зменшення розмірів печінки після лікування серцевими глікозидами та діуретичними засобами. Лікування. Лікування ІЕ має бути якомога більш раннім та етіотропним з урахуванням бактеріологічних даних. До того як антибактеріальні препарати знайшли своє широке застосування в медичній практиці, більшість хворих на ІЕ гинули від інфекції та її ускладнень. Зараз понад 80% успішно виліковуються. Але майже у 20% медикаментозне лікування неефективне, і незабаром у них розвивається серцева недостатність, яка майже не піддається лікуванню. У зв'язку з цим доцільно поєднання консервативного та хірургічного лікування. Для лікування ІЕ у будь-яких вікових групах насамперед використовують антибіотики, які мають бактерицидну дію на мікроорганізми, бажано в індивідуалізованих дозах залежно від концентрації антибіотика в крові та чутливості до нього збудника. Препаратом початкового вибору, як і раніше, є пеніцилін. Він малотоксичний, що дозволяє застосовувати його тривало у відносно високих дозах. Добова доза - до 20 000 000 ОД вводиться внутрішньовенно та внутрішньом'язово. Однак не слід виключати і той факт, що у хворих похилого та старечого віку при лікуванні пеніциліном та іншими антибіотиками у високих дозах часто спостерігається кардіотоксичний ефект: поява або посилення серцевої недостатності, біль у серці, тахікардія. При зменшенні дози чи зміні препарату ці явища усуваються. При невідомій етіології лікування починають з високих доз бензилпеніциліну внутрішньом'язово або внутрішньовенно до 18 000 000 - 20 000 000 ОД і більше, застосовують комбінацію зі стрептоміцином до 1 г в/м на добу або аміноглікозидами (гентаміцин, тобрамі кг на добу). За відсутності ефекту або після визначення збудника використовують напівсинтетичні пеніциліни (оксацилін, метицилін або ампіцилін внутрішньом'язово до 4 г/добу). Цефалоспорини також є базисними препаратами, що застосовуються для лікування ІЕ: найбільш часто використовують клафоран, цефамізин (6-12 г/добу, внутрішньом'язово та внутрішньовенно), а також цепорин (4-10 г/добу) та кефзол (до 10-16 г внутрішньовенно). та ін.). Гарною протистафілококовою дією має фузидин, у ряді випадків він ефективний при резистентності мікроорганізмів до інших антибіотиків (8-10 г/добу). Лікування антибіотиками призначають тривало курсом 1,5-2 місяці, до того часу, поки інфекція буде повністю ліквідована. Після ліквідації інфекції відбувається покращення загального стану хворого, зникають вегетації за даними ЕхоКГ та за результатами мікробіологічного підтвердження. При зниженій імунореактивності організму антибактеріальні засоби поєднують з пасивною імунотерапією (наприклад, при стафілококовому ендокардиті - з антистафілококовою плазмою або антистафілококовим α-глобуліном), з використанням імуномодуляторів (тималіна, Т-активіну та ін.). Для профілактики тромбозів, наприклад, при ендокардиті, що розвинувся на тлі ангіогенного сепсису, створюється регульована гіпокоагуляція за допомогою гепарину (20 000-25 000 ОД внутрішньовенно або підшкірно). Для інгібіції протеолітичних ферментів використовують контрикал (до 40-000 ОД внутрішньовенно краплинно). Коли клапанний ІЕ сприяв формуванню вади клапана серця або прояви захворювання не зникають, незважаючи на масивну антибактеріальну терапію, доцільно проводити хірургічне лікування. Додатковим аргументом на користь оперативного втручання є повторні емболії із зруйнованих інфекцією стулок клапана серця. Іноді інфекція виходить за межі клапанного кільця, утворюючи абсцеси, що також є показанням до хірургічного лікування. Головна мета операції – збереження власного клапана хворого. Іноді обмежуються видаленням вегетацій, ушиванням розривів стулок і т. д. Якщо клапан практично повністю руйнується під впливом інфекції, його замінюють штучним (протезують) за допомогою механічних та біологічних протезів. Профілактика. Профілактика ІЕ полягає у своєчасній санації хронічних вогнищ інфекції в порожнині рота, мигдаликах, носоглотці, придаткових пазухах носа, застосуванні активної антибактеріальної терапії при гострих стрептококових та стафілококових захворюваннях (ангінах та ін.). Рекомендується загартовування організму. Всім хворим з вадами клапанів серця, а також із клапанними протезами необхідно напередодні і невдовзі після проведення будь-якого втручання, після якого в кровотік може потрапити інфекція, профілактично приймати антибіотики. Необхідне диспансерне спостереження осіб, які перенесли гострі стрептококові, стафілококові інфекції. Лекція № 6. Захворювання органів дихання. Бронхіальна астма Вичерпного визначення бронхіальної астми не існує до теперішнього часу, проте найбільш повне визначення даного захворювання було дано Федосєєвим Г. Б. в 1982 р. Бронхіальна астма (БА) - самостійне, хронічне, рецидивне захворювання з переважним ураженням дихальних шляхів, основним і обов'язковим патогенетічним є змінена реактивність бронхів, обумовлена специфічними (імунологічними) та (або) неспецифічними, вродженими або набутими механізмами, а основною (обов'язковою) клінічною ознакою – напад задухи та (або) астматичний стан (астматичний статус) внаслідок спазму гладких м'язів бронхів, гіперсекреції, дискринії та набряку слизової оболонки бронхів. Етіологія. У виникненні бронхіальної астми важливу роль відіграє поєднання ряду факторів. У зв'язку з цим розрізняють 2 форми бронхіальної астми - атопічну (від лат. athopia - "спадкова схильність") і інфекційно-алергічну. Спадкова схильність обумовлена зв'язком деяких антигенів гістосумісності (НЬА) з тяжкістю перебігу бронхіальної астми, а наростання тяжкості захворювання особливо часто відзначається у носіїв антигенів В35 і В40. Внутрішні фактори розвитку хвороби - це біологічні дефекти імунної, ендокринної систем, вегетативної нервової системи, чутливості та реактивності бронхів, мукоциліарного кліренсу, ендотелію судин легень, системи швидкого реагування (огрядні клітини та ін), метаболізму арахідон. Зовнішні фактори включають: 1) інфекційні алергени (віруси, бактерії, гриби, дріжджі тощо); 2) неінфекційні алергени (пилкові, пилові, виробничі, лікарські, харчові; алергени кліщів, комах та тварин); 3) механічні та хімічні подразники (металевий, деревний, силікатний, бавовняний пил; пари кислот, лугів; дими тощо); 4) метеорологічні та фізико-хімічні фактори (зміна температури та вологості повітря, коливання барометричного тиску, магнітного поля Землі, фізичні зусилля тощо); 5) стресові, нервово-психічні впливи та фізичне навантаження. Інфекційні агенти можуть чинити не тільки алергізуючу дію, але й знижувати поріг чутливості організму до неінфекційних (атопічних) алергенів, підвищувати проникність для них слизової оболонки органів дихання; формувати зміну реактивності клітин-мішеней (огрядних клітин, базофілів, моноцитів та ін.) та ефекторних систем. Патогенез. Змінена реактивність бронхів є центральною ланкою патогенезу захворювання і може бути первинною та вторинною. У першому випадку зміна реактивності буває вродженою та набутою внаслідок безпосереднього впливу хімічних та механічних, фізичних факторів та інфекції. Вторинні зміни реактивності бронхів – це прояв змін реактивності імунної, ендокринної, нервової систем організму. Таким чином, говорячи про патогенез БА, можна виділити 2 групи механізмів: імунологічні та неімунологічні. Імунологічні механізми в переважній більшості випадків є домінуючими протягом хвороби. До зміни реактивності бронхів призводять порушення імунокомпетентної системи в слизовій оболонці дихального тракту, що протікають за I, III та IV типами реакцій гіперчутливості, тобто зі зміною гуморального та клітинного імунітетів. При цьому відзначається зменшення секреторного IgА, порушується система фагоцитозу, знижується Т-супресорна функція лімфоцитів, зменшується продукція інтерферону, що призводить до зниження противірусного захисту організму. Тип I (атопічний, реагіновий або анафілактичний). У відповідь на потрапляння в організм антигенів екзоалергенів (пилки рослин, тварин і рослинних білків, бактерій та лікарських препаратів) відбувається підвищена вироблення IgЕ (реагінів), які фіксуються та накопичуються на опасистих клітинах (первинних клітинах-ефекторах). Це імунологічна стадія бронхіальної астми. Після цього розвивається патохімічна стадія процесу - дегрануляція опасистих клітин із вивільненням вазоактивних, бронхоспастических і хемотаксических речовин (гістаміну, серотоніну, різних хемотаксических чинників та інших.). Це первинні медіатори, що діють на судини та клітини-мішені (вторинні клітини-ефектори), - еозинофіли, нейтрофіли, тромбоцити, моноцити-макрофаги. Останні при впливі на них первинних медіаторів виділяють вторинні медіатори (лейкотрієни, простагландини, тромбоксани, тромбоцит-активуючий фактор та інші речовини, що належать до групи ейкозаноїдів). Під впливом біологічно активних речовин настає патофізіологічна стадія патогенезу: підвищується проникність мікроциркуляторного русла, що веде до розвитку набряку, серозного запалення, бронхоспазму. Клінічно це проявляється гострим порушенням прохідності бронхів та розвитком нападу бронхіальної астми. Реакція III типу (імунокомплексний тип, або феномен Артюса) розвивається під впливом екзоалергенів та ендоалергенів (аутоалергенів, до формування яких призводить денатурація білків бронхіол та альвеол внаслідок інфекційного чи алергічного запалення та дії різних подразників). Реакція відбувається в зоні надлишку антигену за участю преципітуючих антитіл, що належать до імуноглобулінів класів Про та М. Пошкоджуюча дія утвореного комплексу антиген - антитіло реалізується через активацію комплементу, звільнення лізосомних ферментів. Відбуваються ушкодження базальних мембран, спазм гладких м'язів бронхів, розширення судин, підвищується проникність мікроциркуляторного русла. Тип IV (клітинний, гіперчутливість уповільненого типу) характеризується тим, що дія, що пошкоджує, мають сенсибілізовані лімфоцити. У цьому випадку медіаторами алергічної реакції є лімфокіни (діють макрофаги, епітеліальні клітини), лізосомні ферменти, а також активована кінінова система. Під впливом цих речовин відбуваються розвиток набряку, набухання слизової оболонки, бронхоспазм, гіперпродукція в'язкого бронхіального секрету. Наслідком є гостре порушення прохідності бронхів, що проявляється нападом ядухи. Неімунологіческіе механізми - це первинна зміна реактивності бронхів в результаті вроджених та набутих біологічних дефектів. Неімунологіческіе механізми діють на первинні або вторинні клітини-ефектори або на рецептори гладких м'язів бронхів, судин, клітин бронхіальних залоз. При цьому змінюється реактивність клітин-мішеней і насамперед опасистих клітин, що супроводжується надмірною продукцією біологічно активних речовин (гістаміну, лейкотрієнів та ін.). У відповідь на їх виділення розвиваються спазм бронхів, набряк слизової оболонки, гіпер-ідискрінія бронхіальних залоз. Все це різко змінює прохідність бронхів та викликає напад задухи. Бронхіальний опір може змінюватися умовно та безумовно-рефлекторно. Наприклад, обструкція, що виникає від впливу холодного повітря, інгаляції дратівливих газів та пилу, фізичного навантаження обумовлена бронхоспазмом через вагусний рефлекс. Причинами бронхоспазму можуть бути також ураження ефекторних зон вагусного бронхоконстриктивного рефлексу або блокада β-адренорецепторів. Останнім часом говорять про особливу роль у патогенезі порушень бронхіальної прохідності глюкокортикоїдної недостатності та дизоваріальних розладів. Недостатність глюкокортикостероїдів призводить до розвитку гіперреактивності опасистих клітин, зниження синтезу катехоламінів, активації простагландинів F2a, а також порушення імунокомпетентної системи (тут говорять про комплексну участь у патогенезі ХА та імунологічних, та неімунологічних механізмів). Гіперестрогенемія та гіпопрогестеронемія впливають α- та β-адренорецептори, підвищуючи активність перших та знижуючи активність останніх. Класифікація. Переважання того чи іншого механізму в патогенезі ТИ БА дозволяє виділити її різні патогенетичні особливості. В даний час використовується класифікація, запропонована Г. Б. Федосєєвим (1982). Етапи розвитку бронхіальної астми. I - передастма (стани, що загрожують розвитком: гострий та хронічний бронхіт, гостра та хронічна пневмонія з елементами бронхоспазму у поєднанні з вазомоторним ринітом, кропив'янкою). II - клінічно оформлена бронхіальна астма (вважається такою після першого нападу або відразу виник астматичного статусу). Форми БА: 1) імунологічна; 2) неімунологічна. Патогенетичні механізми (клініко-патогенетичні варіанти) ХА: 1) атопічний; 2) інфекційнозалежний; 3) аутоімунний; 4) дисгормональний; 5) нервово-психічний дисбаланс; 6) адренергічний дисбаланс; 7) холінергічний дисбаланс; 8) первинно змінена реактивність бронхів. В одного хворого можливе поєднання кількох клініко-патогенетичних варіантів. У такій ситуації необхідно на момент обстеження виділити основний варіант для цього хворого, що важливо для проведення адекватної терапії. У процесі тривалого перебігу бронхіальної астми можлива зміна патогенетичного механізму. Тяжкість перебігу БА: 1) легке протягом (загострення рідкісні, 2-3 десь у рік, не тривалі напади ядухи купуються прийомом різних бронхолітичних препаратів внутрь); 2) середньої тяжкості (частіші загострення 3-4 рази на рік, напади задухи протікають важче і купіруються ін'єкціями лікарських препаратів); 3) тяжкий перебіг (характеризується частими та тривалими загостреннями, тяжкими нападами, які нерідко переходять в астматичний стан). Поділ ХА за тяжкістю течії буває умовним. Так, при легкому перебігу бронхіальної астми хворий може загинути від раптово розвиненого астматичного статусу. Фази перебігу БА: 1) загострення (наявність повторно виникаючих нападів бронхіальної астми або астматичного стану); 2) стихающее загострення (приступи стають більш рідкісними і легкими, фізикальні та функціональні ознаки захворювання виражені менше, ніж у фазу загострення); 3) ремісія (зникають типові прояви бронхіальної астми: напади задухи не виникають; повністю або частково відновлюється прохідність бронхів). ускладнення: 1) легеневі: емфізема легень, легенева недостатність, ателектаз, пневмоторакс, астматичний статус та ін; 2) позалегеневі: легеневе серце (компенсоване та декомпенсоване з розвитком правосерцевої недостатності), дистрофія міокарда та ін. клінічна картина. Найбільш характерна ознака бронхіальної астми - скарги на наявність нападів ядухи (утруднене переважно на видиху дихання), задишку і кашель різного характеру (від сухого, нападоподібного або з виділенням в'язкого мокротиння). Розвиток бронхолегеневої інфекції викликає підвищення температури тіла. Виникло утруднене носове дихання - прояв алергічної риносинусопатії (вазомоторний риніт, поліпоз), що виникає, як правило, у фазу предастми. Дані анамнезу допомагають встановити зв'язок розвитку нападів із впливом певних алергенів та інших факторів. Найчастіше це інфекція дихальних шляхів, особливо у загостренні хвороби. З анамнезу дізнаються про вплив фізичного зусилля (як-от: швидка ходьба, сміх та ін.), Змін метеорологічних факторів (таких як холод, підвищена вологість та ін), дизоваріальних розладів, професійних факторів на виникнення нападів ядухи. Вивчення алергологічного анамнезу сприяє діагностиці атопічного варіанта бронхіальної астми. У подібних випадках загострення хвороби мають сезонний характер (частіше навесні та влітку), супроводжуються ринітом, кон'юнктивітом. У таких хворих бувають кропив'янка, набряк Квінке; виявляється непереносимість харчових продуктів, низки лікарських речовин; відзначається спадкова схильність до алергічних захворювань. Дані анамнезу часто дають змогу встановити наявність так званої аспіринової астми. У разі відсутня спадкова форма алергічних захворювань. Таких хворих турбує порушене носове дихання (поліпозні розростання), а найбільш характерний симптом – непереносимість нестероїдних протизапальних препаратів (ацетилсаліцилової кислоти, індометацину та ін.), що спричиняють астматичні напади. У такому разі вже можна припустити простагландиновий механізм бронхіальної астми. Дані про розвиток у минулому астматичного статусу свідчать про тяжкість перебігу захворювання та вказують на необхідність проведення кортикостероїдної терапії. Діагностика. Велике значення має виявлення позалегеневих проявів алергії, ознак бронхообструкції, ускладнень бронхіальної астми, інших захворювань, що супроводжуються нападами бронхоспазму. При обстеженні шкірних покривів можна виявити алергічні прояви: кропив'янку, еритематозні папульозні висипання, що свідчить про імунологічний варіант бронхіальної астми. Поєднання бронхіальної астми з екземою, нейродермітом, псоріазом привертає до важкого перебігу астми. Часто можна виявити порушення носового дихання. Риніти та поліпи розглядаються як предастма. Гайморити та інші синусити можуть провокувати ядуху. При фізикальному дослідженні легень, часто внаслідок хронічного хронічного бронхіту, можуть бути виявлені ознаки емфіземи, що веде до розвитку хронічної дихальної недостатності і легеневого серця. Аускультативно виявляються ознаки бронхіальної обструкції: зміна дихання (подовжений видих, сухі, переважно свистячі, хрипи), форсований видих, що дозволяє виявити прихований бронхоспазм (поява або наростання сухих хрипів). Аускультацію легень обов'язково проводять у положенні хворого лежачи: кількість сухих хрипів збільшується при їх "вагусному" механізмі. Вологі дзвінкі ("тріскучі") хрипи, що постійно вислуховуються на певній ділянці, можуть свідчити про розвинений пневмосклероз. При об'єктивному обстеженні хворого виявляються симптоми інших захворювань ("метелик" на шкірі обличчя, лімфоаденопатія у поєднанні зі збільшенням печінки та селезінки, стійке підвищення артеріального тиску, завзята лихоманка та ін.), при яких виникають напади бронхоспазму, що проявляються задухою (системна вузликовий періартеріїт). Тоді передбачуваний діагноз бронхіальної астми стає малоймовірним. Спірографія виявляє характерні ознаки порушення бронхіальної прохідності за обструктивним типом: зниження обсягу форсованого видиху за першу секунду (ОФВ1), зменшення коефіцієнта Тіффно (співвідношення ОФВ)1 до ЖЕЛ у відсотках) та відсоткового відношення ОФВ1 до ФЖЕЛ. При загостренні бронхіальної астми на 100 % і більше перевищують вихідний рівень залишковий обсяг легень (ООЛ) і функціональну залишковість ємності (ФОБ). При аналізі спірограми виявляються ознаки трахеобронхіальної дискінезії, що сприяє порушенню бронхіальної прохідності за наявності зазубрини у верхній частині низхідного кольору спірограми (симптом Колбета-Вісса). Пневмотахометрия показує переважання потужності вдиху над потужністю видиху, характерне бронхіальної обструкції. За даними пневмотахографії з побудовою кривої "потік - обсяг" діагностується порушення бронхіальної прохідності окремо лише на рівні великих, середніх та дрібних бронхів. Поява підвищеного бронхіального опору, зареєстрованого за допомогою спірографії, пневмотахометрії та пневмотахографії, у відповідь на фізичне навантаження, вдихання холодного повітря, подразнюючих газів та ацетилхоліну свідчить про змінену реактивність бронхів. Алергологічне тестування проводиться за допомогою набору різноманітних неінфекційних та інфекційних алергенів, що здійснюється лише поза загостренням захворювання. Для оцінки провокуючої дії алергену проводять шкірні алергічні проби (аплікаційний, скарифікаційний та внутрішньошкірний способи нанесення алергену), алерген можна наносити на кон'юнктиву ока, слизову оболонку носа. Найбільш достовірною є специфічна діагностика БА – виявлення специфічної гіперреактивності бронхів за допомогою інгаляційних провокаційних тестів. Однак треба не зважати і на те, що такий шлях введення може спровокувати тяжкий напад БА або розвиток астматичного статусу. Для специфічної діагностики бронхіальної астми, наприклад, при неможливості проведення алергологічного тестування, застосовують також радіоімуно-сорбентний тест, що дозволяє кількісно оцінити IgE-антитіла. Лабораторні дослідження допомагають підтвердити передбачуваний діагноз, оцінити еволюцію захворювання та ефективність лікування. Головний діагностичний критерій бронхіальної астми - поява еозинофілів у мокротинні, проте це неспецифічна ознака, він може бути проявом загальної алергічної реакції організму. Також діагностичне значення має виявлення у харкотинні спіралей Куршмана та кристалів Шарко-Лейдена. Лабораторні дослідження доводять наявність активного запального процесу та ступінь його виразності щодо збільшення острофазових показників. При збільшенні дихальної недостатності у разі загострення бронхіальної астми та астматичного статусу важливим є дослідження кислотно-основного стану та газового складу крові. Рентгенологічне дослідження діагностує вогнища інфекції (у придаткових пазухах, зубах, жовчному міхурі) та наявність гострого (пневмонія) або загострення хронічного запального процесу у легенях, емфіземи легень та пневмосклерозу. Дані ЕКГ доводять ознаки розвитку компенсованого легеневого серця – гіпертрофію правих відділів серця. Диференціальна діагностика. БА диференціюють із серцевою астмою (див. табл. 8). Таблиця 8 Диференційна діагностика БА
Необхідно також диференціювати інфекційно-алергічну та атопічну бронхіальну астму (див. табл. 9). Таблиця 9 Інфекційно-алергічна та атопічна БА
Лікування. У терапії бронхіальної астми рекомендується ступінчастий підхід, що пояснюється варіабельною тяжкістю її перебігу у різних людей і в одного і того ж пацієнта. Ступінь 1 – найменша тяжкість перебігу астми, ступінь 4 – найбільша. Ступінь 1. Легкий інтермітуючий перебіг, у разі якого симптоми бронхіальної астми з'являються при експозиції тригера (наприклад, пилку або вовни тварин) або внаслідок фізичного навантаження. Тривале використання протизапальних препаратів у терапії таких хворих не показано. Лікування полягає у профілактичному прийомі ліків за необхідності (призначаються інгаляційні β2-агоністи, кромоглікат, недокроміл або антихолінергічні препарати). Іноді більш тяжкі та тривалі загострення вимагають призначення короткого курсу пероральних кортикостероїдів. Якщо астма проявляється більш частими симптомами, збільшенням потреби у бронходилататорах, виникає необхідність переходу до наступного ступеня. Ступінь 2. Легкий персистуючий перебіг. Первинна терапія включає прийом протизапальних препаратів, інгаляційних кортикостероїдів, кромоглікату натрію або недокромілу натрію. Дозування кортикостероїдів – 200-500 мкг беклометазону дипропіонату або будесоніду на день. Для симптоматичного лікування можна використовувати інгаляційні β2-агоністи, але не частіше 3-4 разів на добу. При більш тяжких та тривалих загостреннях призначається короткий курс пероральних кортикостероїдів. Якщо симптоми персистують, незважаючи на початкову дозу інгаляційних кортикостероїдів, дозу беклометазону дипропіонату слід збільшити до 750-800 мкг на добу. Однак альтернативою збільшення дози інгаляційних гормонів, особливо для контролю нічних нападів бронхіальної астми, є додавання бронходилататорів пролонгованої дії, що приймаються на ніч (при дозі інгаляційних кортикостероїдів не менше 500 мкг). Ступінь 3 характеризується середньою тяжкістю перебігу бронхіальної астми. Таким хворим необхідний щоденний прийом профілактичних протизапальних препаратів. Доза інгаляційних кортикостероїдів – 800-2000 мкг у поєднанні з бронходилататорами тривалої дії. Можна застосовувати теофіліни тривалої дії (при постійному моніторингу їхньої концентрації не більше 5-15 мкг/мл), пероральні та інгаляційні β2-Агоністи тривалої дії. Симптоматично призначають β2-агоністи короткої дії або альтернативні препарати (ступінь 2). Ступінь 4. Тяжкий перебіг бронхіальної астми, коли повністю контролювати її не вдається. У цьому випадку мета лікування – досягнення найкращих можливих результатів. Первинне лікування передбачає призначення інгаляційних кортикостероїдів у високих дозах (від 800 до 2000 мкг на день беклометазону дипропіонату) у поєднанні з бронходилататорами пролонгованої дії. За потреби для полегшення симптомів показані інгаляційні β2-агоністи короткої дії (не частіше 3-4 разів на добу). Більш тяжке загострення може вимагати проведення курсу лікування пероральними кортикостероїдами, які призначаються у мінімальних дозах або через день. Для запобігання розвитку побічних явищ, високі дози інгаляційних кортикостероїдів вводять через спейсер. Ступінь 5 передбачає зменшення підтримуючої медикації. Це можливо, якщо астма залишається під контролем не менше 3 місяців, що допомагає зменшити ризик побічної дії та підвищує сприйнятливість хворого до запланованого лікування. "Зменшення" лікування проводиться під постійним контролем симптомів, клінічних проявів та показників функцій зовнішнього дихання за допомогою поступового зниження (скасування) останньої дози або додаткових препаратів. Купірування нападів. Легкий напад можна усунути вдома бронходилататорами короткої дії. Лікування проводиться до зникнення симптомів. Приступи середньої тяжкості та тяжкі вимагають не лише адекватних доз бронходилататорів короткої дії (інгаляційних β2-агоністів короткої дії), а також призначення системних кортикостероїдів. За наявності у хворого на гіпоксемію необхідно призначити кисень. Для лікування нападів задухи в умовах медичного центру або лікарні призначають високі інгаляційні дози β2-агоністів через небулайзер. Дуже ефективним є застосування дозованого аерозольного інгалятора через спейсер. Переважним є призначення кортикостероїди перорально, не внутрішньовенно. При застосуванні теофіліну або амінофіліну у поєднанні з високими дозами β2-агоністів додатковий бронходилатируючий ефект не забезпечується, але підвищується ризик розвитку побічних явищ. Теофіліни можуть застосовуватися лише у відсутності β2-агоністів, однак вони можуть призначатися внутрішньовенно з розрахунку 6 мг/кг амінофіліну (або 5 мг/кг теофіліну) з підтриманням постійної дози 0,5-1,0 мг/кг на годину протягом 24 годин. Як альтернатива β2-агоністам короткої дії також може застосовуватися адреналін, проте при його використанні можливі значні побічні явища. Для лікування нападів астми, щоб уникнути посилення кашлю, не рекомендуються інгаляційні муколітичні препарати, заборонені седативні та антигістамінні препарати, сульфат магнію, фізіотерапія на грудну клітину, гідратація великими обсягами рідини для дорослих та дітей старшого віку. Профілактика. Первинна профілактика бронхіальної астми включає лікування хворих у стані передастми, виявлення у практично здорових осіб з обтяженою спадковістю біологічних дефектів, що становлять загрозу виникнення бронхіальної астми, усунення з навколишнього хворих середовища потенційно небезпечних алергенів, ірритантів та інших факторів, які можуть призвести до розвитку хвороби. При лікуванні хворих у стані передастми необхідно санувати осередки інфекції, проводити терапію алергічної риносинусопатії, застосовувати різні методи немедикаментозного лікування, включаючи голко- та психотерапію, ЛФК, баротерапію, санаторно-курортне лікування. Показано проведення специфічної та неспецифічної гіпосенсибілізації. Лекція № 7. Захворювання органів дихання. Хронічний бронхіт Хронічний обструктивний бронхіт - дифузне неалергічне запальне ураження бронхіального дерева, обумовлене тривалим дратівливим впливом на бронхи різних агентів, що має прогресуючий перебіг і характеризується порушенням легеневої вентиляції по обструктивному типу, слизоутворення і дренуючої функції бронхіального дерева. Згідно з визначенням ВООЗ, якщо хворий відкашлює мокротиння протягом більшості днів не менше 3 місяців поспіль протягом 2 років поспіль, захворювання розглядається як хронічний бронхіт (ХБ). Хронічний бронхіт поділяється на первинний та вторинний. Первинний ХБ - самостійне захворювання, не пов'язане з іншими бронхолегеневими процесами або ураженням інших органів та систем, при якому спостерігається дифузне ураження бронхіального дерева. Вторинний ХБ розвивається і натомість інших захворювань - як легеневих (туберкульоз, бронхоектатична хвороба тощо. буд.), і позалегеневих (уремія, застійна серцева недостатність тощо. буд.). Найчастіше має локальний характер (сегментарний). Розглянемо первинний ХБ. Етіологія. У розвитку ХБ відіграють роль як екзогенні фактори (тютюновий дим, забруднення повітря, несприятливі професійні умови, кліматичні та інфекційні фактори), так і ендогенні фактори (патологія носоглотки, порушення дихання через ніс, повторні гострі респіраторні захворювання, гострі бронхіти та вогнищеві). шляхів, спадкова схильність, порушення обміну речовин (ожиріння)). Патогенез. Під впливом екзогенних та за участю ендогенних факторів у трахеобронхіальному дереві змінюються структурно-функціональні властивості слизової оболонки та підслизового шару, розвивається запалення слизової оболонки, порушуються прохідність та дренажна функція бронхів. Структурно-функціональні зміни слизової оболонки та підслизового шару виражаються в гіперплазії та гіперфункції бокалоподібних клітин, бронхіальних залоз, гіперсекреції густого та в'язкого слизу, що призводить до порушення в системі мукоциліарного транспорту. Кількість виробленого секреторного IgA-лізоциму та лактоферину знижується. Розвивається набряк слизової оболонки, а потім – атрофія та метаплазія епітелію. Запалення слизової оболонки викликають різні дратівливі речовини у поєднанні з інфекцією (вірусною та бактеріальною). Хімічні речовини (поллютанти), що містяться в повітрі, надають шкідливу дію на дихальні шляхи, виникає набряк слизової оболонки і відбувається гальмування активності війчастого епітелію. Це призводить до порушення евакуаторної та зниження бар'єрної функції слизової оболонки бронхів. Катаральний вміст змінюється катарально-гнійним, а потім гнійним. Поширення запального процесу на дистальні відділи бронхіального дерева порушує вироблення сурфактанту та знижує активність альвеолярних макрофагів, що фагоцитують чужорідні частки. Якщо бронхоспазм, що виник у разі запалення, виражений різко, то розвивається бронхоспастичний (неалергічний) компонент. Інфекція, що приєдналася при загостренні запалення сприяє розвитку астматичного (алергічного) компонента, що дозволяє віднести такий ХБ до передастми. Обструктивний синдром розвивається внаслідок поєднання ряду факторів: 1) спазму гладких м'язів бронхів внаслідок дратівливого впливу екзогенних факторів та запальних змін слизової оболонки; 2) гіперсекреції слизу, зміни її реологічних властивостей, що призводять до порушення мукоциліарного транспорту та закупорки бронхів в'язким секретом; 3) метаплазії епітелію з циліндричного в багатошаровий плоский та його гіперплазії; 4) порушення вироблення сурфактанту; 5) запального набряку та інфільтрації слизової оболонки; 6) колапсу дрібних бронхів та облітерації бронхіол; 7) алергічних змін слизової оболонки. Якщо процес залучаються бронхи великого калібру (проксимальний бронхіт), порушення бронхіальної прохідності не виражені. Але у разі ураження дрібних та середніх бронхів виникає виражене порушення бронхіальної прохідності. Однак при ізольованому ураженні дрібних бронхів (дистальний бронхіт), позбавлених кашлевих рецепторів, задишка може бути єдиним свідченням бронхіту, що розвинувся, а кашель з'являється при залученні в процес більших бронхів. Різні співвідношення змін слизової оболонки зумовлюють формування певної клінічної форми: 1) при катаральному необструктивному бронхіті превалюють поверхневі зміни структурно-функціональних властивостей слизової оболонки; 2) при слизово-гнійному (гнійному) бронхіті переважають процеси інфекційного запалення. Однак можлива і ситуація, коли тривалий катаральний бронхіт внаслідок приєднання інфекції може стати слизово-гнійним і т. п. При необструктивному варіанті всіх клінічних форм ХБ вентиляційні порушення виражені незначно; 3) обструктивні порушення спочатку з'являються лише на тлі загострення захворювання та обумовлені запальними змінами бронхів, гіпер- та дискринією, бронхоспазмом (оборотними компонентами обструкції), але потім зберігаються постійно, при цьому обструктивний синдром наростає повільно. При обструктивному ХБ переважають потовщення слизової оболонки та підслизового шару, набряк та гіперсекреція, також характерні стійкі порушення вентиляції. Обструкція дрібних бронхів, що розвинулася, призводить до емфіземи легень. У своїй течії ХБ зазнає певної еволюції. В результаті розвитку емфіземи та пневмосклерозу відзначається нерівномірна вентиляція легень, утворюються гіпер- та гіповентильовані ділянки. У поєднанні з місцевими запальними змінами це призводить до порушення газообміну, дихальної недостатності, артеріальної гіпоксемії та легеневої гіпертензії з подальшим розвитком основного загрозливого життя стану – правошлуночкової недостатності. Класифікація. Загальноприйнятої класифікації ХБ нині немає. Важливим є поділ ХБ на обструктивний та необструктивний варіанти, при кожному з яких може розвинутись катаральний (слизовий), катарально-гнійний або гнійний запальний процес. У класифікацію включені також форми, що рідко зустрічаються - геморагічний і фібринозний ХБ. За рівнем ураження бронхів виділяють: з переважним ураженням, великих бронхів (проксимальний бронхіт) та з переважним ураженням дрібних бронхів (дистальний бронхіт) (Палеєв Н. Р., 1985). клінічна картина. Основними симптомами ХБ є кашель, виділення мокротиння, задишка. При загостренні хвороби або внаслідок гіпоксії при розвитку легеневої недостатності та інших ускладнень виявляють симптоми загального характеру (потівливість, слабкість, підвищення температури тіла, стомлюваність тощо). Кашель є типовим проявом хвороби. За його характером та консистенцією мокротиння можна припустити варіант перебігу захворювання. При необструктивному варіанті катарального бронхіту кашель супроводжується виділенням невеликої кількості слизової водянистої мокротиння (частіше вранці, після фізичних вправ або у зв'язку з почастішанням дихання). На початку хвороби кашель не турбує хворого; Поява нападоподібного кашлю вказує на розвиток бронхіальної обструкції. Кашель набуває відтінку гавкаючого і носить пароксизмальний характер при вираженому експіраторному колапс трахеї і великих бронхів. При гнійному та слизово-гнійному бронхіті хворих більше непокоїть виділення при кашлі мокротиння. У разі загострення хвороби мокротиння набуває гнійного характеру, її кількість збільшується, іноді мокрота виділяється насилу (внаслідок бронхіальної обструкції при загостренні). При обструктивному варіанті бронхіту кашель малопродуктивний та надсадний, супроводжується задишкою, з невеликою кількістю мокротиння. Задишка виникає у всіх хворих на ХБ у різні терміни. Поява у "довго кашляючих" хворих задишки спочатку при значному фізичному навантаженні свідчить про приєднання бронхіальної обструкції. У міру прогресування хвороби задишка стає більш вираженою та постійною, тобто розвивається дихальна (легенева) недостатність. При необструктивному варіанті ХБ прогресує повільно, задишка з'являється зазвичай через 20-30 років після початку хвороби. Такі хворі на початок хвороби майже ніколи не фіксують, а вказують тільки на появу ускладнень або частих загострень. В анамнезі виявляється підвищена чутливість до охолодження, більшість хворих вказують на тривале куріння. У багатьох хворих захворювання пов'язані з професійними шкідливими з виробництва. При аналізі кашльового анамнезу необхідно переконатися у відсутності у хворого на іншу патологію бронхолегеневого апарату (туберкульозу, пухлини, бронхоектазів, пневмоконіозів, системних захворювань сполучної тканини тощо), що супроводжується тими самими симптомами. Іноді в анамнезі вказується кровохаркання через легку ранимість слизової оболонки бронхів. Рецидивне кровохаркання вказує на геморагічну форму бронхіту. Крім цього, кровохаркання при хронічному, тривало протікає бронхіті може бути першим симптомом раку легені або бронхоектазів. Діагностика. При аускультації виявляються жорстке дихання (при розвитку емфіземи може стати ослабленим) і сухі хрипи розсіяного характеру, тембр яких залежить від калібру уражених бронхів (добрі хрипи, що вислуховуються на видиху, характерні для ураження дрібних бронхів). Зміни даних аускультації будуть мінімальними при хронічному необструктивному бронхіті у стадії ремісії та найбільш виражені при загостренні процесу (вологі хрипи різного калібру, які можуть зникати після хорошого відкашлювання та виділення мокротиння). При загостренні обструктивного бронхіту задишка посилюється, наростають явища дихальної недостатності. Гнійний в'язкий секрет ще більше ускладнює прохідність бронхів. Обструктивний компонент, що приєднався як до катаральної та слизово-гнійної форм бронхіту, так і в період загострення або в процесі їх еволюції значно ускладнює перебіг бронхіту. Ознаки бронхіальної обструкції: подовження фази видиху при спокійному та особливо форсованому диханні; свистячі хрипи на видиху (краще вислуховуються при форсованому диханні та в положенні лежачи); симптоми обструктивної емфіземи легень. У деяких випадках ХБ і при приєднанні ускладнень з'являються ознаки емфіземи легень, дихальної та серцевої (правошлуночкової) недостатності - декомпенсованого легеневого серця: акроціаноз, пастозність або набряклість гомілок і стоп, зміни нігтів у вигляді годинникових стекол, а кінцевих фала вигляді барабанних паличок, набухання шийних вен, пульсація в епігастральній ділянці за рахунок правого шлуночка, акцент II тону у II міжребер'ї зліва від грудини, збільшення печінки. Впливає на картину хвороби та приєднання астматичного (алергічного) компонента, коли з'являється подібність до бронхіальної астми. Лабораторно-інструментальні показники мають різну міру значущості залежно від стадії перебігу процесу. У початковому періоді хвороби чи фазі ремісії змін може бути. Однак ці показники набувають великого значення для виявлення активності запального процесу; уточнення клінічної форми захворювання; виявлення ускладнень; диференціальної діагностики із захворюваннями, що мають подібні клінічні симптоми. Рентгенологічне дослідження органів грудної клітки проводиться всім хворим на ХБ, проте, як правило, на оглядових рентгенограмах зміни в легенях відсутні. Може спостерігатись сітчаста деформація легеневого малюнка, обумовлена розвитком пневмосклерозу. При тривалому перебігу процесу виявляються ознаки емфіземи легень. При розвитку легеневого серця з'являються вибухання стовбура легеневої артерії на лівому контурі тіні серця, розширення прикореневих артерій з подальшим конусоподібним звуженням і зменшенням діаметра периферичних розгалужень. Рентгенологічне дослідження відіграє важливу роль у діагностиці ускладнень (гостра пневмонія, бронхоектази) та у диференціальній діагностиці із захворюваннями зі подібними симптомами. Бронхографія використовується лише для діагностики бронхоектазів. Бронхоскопія має велике значення у діагностиці ХБ та диференціації його від захворювань, що проявляються подібною клінічною картиною. Вона підтверджує наявність запального процесу; уточнює характер запалення (діагноз геморагічного чи фібринозного бронхіту ставлять лише після цього дослідження); виявляє функціональні порушення трахеобронхіального дерева (особливо важливим є виявлення експіраторного колапсу - дискінезії трахеї та великих бронхів); допомагає у виявленні органічних уражень бронхіального дерева. Крім того, бронхоскопія дозволяє одержати вміст бронхів або промивні води для мікробіологічного, паразитологічного та цитологічного досліджень. Дослідження функції зовнішнього дихання проводять виявлення рестриктивних і обструктивних порушень легеневої вентиляції. За спірограмою розраховують індекс Тіффно (відношення обсягу форсованого видиху в 1 с - ОФВ)1 до життєвої ємності легень – ЖЕЛ у відсотках) та показник швидкості руху повітря – ПСДВ (ставлення максимальної вентиляції легень – МВЛ до ЖЕЛ). При розвитку обструктивного синдрому відзначається зниження абсолютних швидкісних показників зовнішнього дихання (МВЛ та ОФВ)1), що перевищує ступінь зменшення ЖЕЛ; знижується індекс Тіффно і зростає бронхіальний опір на видиху. За даними пневмотахометрії виявляється переважання потужності вдиху над потужністю видиху як рання ознака бронхіальної обструкції. Виявлення порушень бронхіальної прохідності на різних рівнях бронхіального дерева можливе за допомогою спеціальних пневмотахографів, що дозволяють отримати криву "потік-об'єм". Для периферичної обструкції характерне значне зниження кривої "потік - обсяг" дільниці малого обсягу. Визначити рівень обструкції допомагає також спільна оцінка величини бронхіального опору та легеневих обсягів. У разі обструкції лише на рівні великих бронхів відзначається збільшення залишкового обсягу легких (ООЛ), а загальна ємність легких (ОЕЛ) не зростає. При периферичній обструкції спостерігаються більш значне зростання ООЛ та збільшення ОЕЛ. Для виявлення питомої ваги бронхоспазму у спільній частці бронхіальної обструкції вивчають показники вентиляції та механіки дихання після проведення низки фармакологічних проб. Після вдихання аерозолів бронхолітичних препаратів показники вентиляції покращуються за наявності спастичного компонента обструкції дихальних шляхів. Радіопульмонографія з використанням радіоактивного ізотопу 133Хе проводиться для виявлення нерівномірності вентиляції, пов'язаної з обструкцією дрібних бронхів. Це найбільш рання діагностична ознака такого виду бронхіальної обструкції. Електрокардіографія необхідна для виявлення гіпертрофії правого шлуночка і правого передсердя, що розвивається при легеневій гіпертензії. Виявляються виражене відхилення осі QRS вправо, зміщення перехідної зони вліво (R/S < 1 V4-V6), S-тип ЕКГ; високий гострий зубець Р у відведеннях VF, ІІІ, ІІ. Клінічний аналіз крові виявляє вторинний еритроцитоз, що виник унаслідок хронічної гіпоксії при розвитку вираженої легеневої недостатності. "Острофазові" показники виражені помірно: ШОЕ нормальна або збільшена помірно, лейкоцитоз невеликий, так само як і зсув лейкоцитарної формули вліво. Як свідчення алергічних проявів можлива еозинофілія. Дослідження мокротиння та бронхіального вмісту допомагає встановити вираженість запалення. При вираженому запаленні вміст гнійний або гнійно-слизовий містить багато нейтрофілів і поодинокі макрофаги, мізерно представлені дистрофічно змінені клітини миготливого і плоского епітелію. Для помірного запалення характерний вміст ближче до слизово-гнійного; кількість нейтрофілів зменшено, зростає кількість макрофагів, слизу та клітин бронхіального епітелію. При слабко вираженому запаленні бронхіальний вміст слизовий, переважають злущені клітини епітелію, бронхів; макрофагів та нейтрофілів мало. Мікробіологічне дослідження мокротиння та вмісту бронхів є важливим для виявлення етіології загострення хронічного бронхіту та вибору антимікробної терапії. Диференціальна діагностика. Таблиця 10 Диференційно-діагностичні критерії ХБ
Лікування. Включає комплекс заходів, що різняться у період загострення та ремісії хвороби. У період загострення ХБ виділяються два напрями лікування: етіотропний та патогенетичний. Етіотропне лікування спрямоване на ліквідацію запального процесу в бронхах: показана терапія антибіотиками, сульфаніламідними препаратами, антисептиками, фітонцидами та ін. Починають лікування з антибіотиків пеніцилінового ряду (пеніцилін, ампіцилін) або групи цефалоспоринів резерву (гентаміцин та ін). Найбільш кращий спосіб введення – інтратрахеальний (аерозоль або заливка гортанним шприцом через бронхоскоп). Патогенетичне лікування спрямоване на покращення легеневої вентиляцій; відновлення бронхіальної прохідності; боротьбу з легеневою гіпертензією та правошлуночковою недостатністю. Відновленню легеневої вентиляції, крім ліквідації запального процесу в бронхах, сприяють оксигенотерапія та заняття ЛФК. Основне в терапії ХБ – відновлення прохідності бронхів – досягається шляхом поліпшення їхнього дренажу та ліквідації бронхоспазму. Для поліпшення бронхіального дренажу призначають відхаркувальні (гаряче лужне пиття, відвари трав, мукалтин та ін), муколітичні препарати (ацетилцистеїн, бромгексин; при гнійному в'язкому секреті - аерозолі протеолітичних ферментів - хімопсину, трипсину); використовується лікувальна бронхоскопія. Для ліквідації бронхоспазму використовують еуфілін (внутрішньовенно, у свічках, таблетках), ефедрин, атропін; можливі разові призначення в аерозолі симпатоміметичних препаратів: фенотеролу, орципреналіну сульфату (астмопенту) та нового вітчизняного препарату "Совентол", холінолітичних препаратів: атровенту, тровентолу. Ефективні препарати пролонгованого еуфіліну (теопек, теодур, теобелонг та ін.) – 2 рази на добу. За відсутності ефекту такої терапії вводять невеликі дози кортикостероїдів внутрішньо (10-15 мг преднізолону на добу) або інтратрахеально (суспензія гідрокортизону – 50 мг). Як додаткову терапію призначають: 1) протикашльові препарати: при малопродуктивному кашлі – лібексин, тусупрекс, бромгексин, при надсадному кашлі – кодеїн, діонін, стоптусин; 2) лікарські засоби, що підвищують опірність організму: вітаміни А, С, групи В, біогенні стимулятори. В даний час при лікуванні ХБ все ширше застосовують імунокоригуючі препарати: Т-активін або тималін (по 100 мг підшкірно протягом 3 днів); всередину – катерген, нуклеїнат натрію або пентоксил (протягом 2 тижнів), левамізол (декарис). Фізіотерапевтичне лікування: призначають діатермію, електрофорез хлориду кальцію, кварц на ділянку грудної клітки, масаж грудної клітки та заняття дихальною гімнастикою. При бронхіті середньої тяжкості та тяжкому поряд із протирецидивним та санаторно-курортним лікуванням багато хворих змушені постійно отримувати підтримуюче медикаментозне лікування. Підтримуюча терапія спрямована на покращення прохідності бронхів, зниження легеневої гіпертензії та боротьбу з правошлуночковою недостатністю. Призначають самі препарати, що у період загострення, лише у менших дозах, курсами. Прогноз. Прогноз щодо повного одужання несприятливий. Найменш сприятливий прогноз при обструктивних ХБ та ХБ з переважним ураженням дистальних відділів бронхів, що швидко призводить до розвитку легеневої недостатності та формування легеневого серця. Найбільш сприятливий прогноз при поверхневому (катаральному) ХБ без обструкції. Лекція № 8. Захворювання органів дихання. Пневмонія Пневмонія - гостре інфекційно-запальне захворювання, що має осередковий характер, при якому в патологічний процес залучаються респіраторні відділи та інтерстиційна сполучна тканина легень. Класифікація Є. В. Гембицького (1983). За етіологією: 1) бактеріальні (із зазначенням збудника); 2) ірусні (із зазначенням збудника); 3) корнітозні; 4) рикетсіозні; 5) мікоплазмові; 6) грибкові; 7) змішані; 8) інфекційно-алергічні; 9) невстановленої етіології. За патогенезу: 1) первинні (самостійний гострий запальний процес); 2) вторинні (ускладнення хвороб серцево-судинної системи з порушенням кровообігу в малому колі, хронічні хвороби нирок, системи крові, обміну речовин, інфекційні хвороби або розвиваються на тлі хронічних захворювань органів дихання). Клініко-морфологічна характеристика: 1) паренхіматозні (для пневмококової пневмонії): крупозні; осередкові; 2) інтерстиціальні. По локалізації та протяжності: односторонні; двосторонні. За тяжкістю: украй важкі; важкі; середньої тяжкості; легкі та абортивні. За течією: гострі; затяжні (рентгенологічний та клінічний дозвіл пневмонії). Етіологія. Більшість пневмоній мають інфекційне походження. Пневмонії алергічні та обумовлені дією фізичних чи хімічних факторів трапляються рідко. Бактеріальні пневмонії діагностуються частіше у осіб середнього та похилого віку; вірусні пневмонії – у молодих. В етіології первинних бактеріальних пневмоній провідна роль належить пневмококам. У період епідемії грипу зростає роль вірусно-бактеріальних асоціацій (частіше за стафілококи), а також умовно-патогенних мікроорганізмів. При вторинних пневмоніях провідну етіологічну роль грають грамнегативні бактерії (клебсієла пневмонії та паличка інфлюенцы); у виникненні аспіраційних пневмоній велике значення анаеробної інфекції. Патогенез. Інфекційний збудник потрапляє ззовні до респіраторних відділів легень через бронхи: інгаляційно та аспіраційно (з носо- або ротоглотки). Гематогенним шляхом збудник потрапляє до легень переважно при вторинних пневмоніях або при тромботичному генезі пневмоній. Лімфогенне поширення інфекції з появою пневмонії спостерігається лише при пораненнях у грудну клітину. Є також ендогенний механізм розвитку запалення у легеневій тканині, зумовлений активацією мікрофлори, що знаходиться у легенях. Роль його велика за вторинних пневмоніях. Розвитку пневмонії сприяють несприятливі фактори зовнішнього та внутрішнього середовища, під впливом яких відбуваються зниження загальної неспецифічної резистентності організму (пригнічення фагоцитозу, вироблення бактеріолізинів та ін.) та пригнічення місцевих захисних механізмів (порушення мукоциліарного кліренсу та макро. . Істотне значення у патогенезі пневмоній надається також алергічним та аутоалергічним реакціям. Сапрофіти та патогенні мікроорганізми, стаючи антигенами, сприяють виробленню антитіл, які фіксуються на клітинах слизової оболонки дихальних шляхів, де відбувається реакція антиген - антитіло, що призводить до пошкодження тканин та розвитку запального процесу. За наявності загальних антигенних детермінантів мікроорганізмів та легеневої тканини або при пошкодженні легеневої тканини вірусами, мікроорганізмами, токсинами та токсичними речовинами, що призводить до прояву її антигенних властивостей, розвиваються аутоалергічні процеси. Ці процеси сприяють більш тривалому існуванню патологічних змін та затяжному перебігу хвороби. клінічна картина. Основні синдроми: 1) інтоксикаційний (загальна слабкість, розбитість, головні та м'язові болі, задишка, серцебиття, блідість, зниження апетиту); 2) синдром загальних запальних змін (почуття жару, озноб, підвищення температури тіла, зміна острофазрвих показників крові: лейкоцитоз зі зсувом лейкоцитарної формули вліво, збільшення ШОЕ, рівня фібриногену, α2-глобулінів, поява С-реактивного білка); 3) синдром запальних змін легеневої тканини (поява кашлю та мокротиння, укорочення перкуторного звуку), посилення голосового тремтіння та бронхофонії, зміна частоти та характеру дихання, поява вологих хрипів, рентгенологічні зміни; 4) синдром залучення інших органів та систем. Ступінь виразності цих проявів характеризує тяжкість перебігу пневмонії (див. табл. 11). Таблиця 11 Симптоми та перебіг пневмонії
На різних етапах перебігу пневмонії клінічна картина може змінюватися від приєднання тих чи інших ускладнень: легеневих та позалегеневих. Легкові: абсцедування; плеврит (пара-і метапневмонічний), рідше – емпієма плеври; приєднання астматичного компонента, можливе формування набряку легень та розвитку гострої дихальної недостатності. Позалегеневі ускладнення: інфекційно-токсичний шок (з явищами гострої судинної, гострої лівошлуночкової та ниркової недостатності, виразками слизової оболонки травного тракту та кровотечею, розвитком дисемінованого внутрішньосудинного згортання крові; інфекційно-ацеїт; .При тяжкому перебігу крупозної пневмонії можливий розвиток інтоксикаційних психозів, а при зливних тотальних пневмоніях - гострого легеневого серця. Основні скарги хворого на пневмонію: на кашель, виділення мокротиння, біль у грудній клітці, що посилюються при диханні та кашлі, задишку, порушення загального самопочуття, підвищення температури тіла. Кашель може бути сухим або з виділенням мокротиння (слизової, слизово-гнійної, гнійно-слизової, кров'яної). "Іржаве" мокротиння характерне для крупозної пневмонії, кров'яниста - для пневмоній, викликаних клебсієллою (паличка Фрідлендера) та вірусної пневмонії; гнійне кров'яне мокротиння свідчить про пневмонію стрептококового генезу. Завзятий кашель з невеликою кількістю слизово-гнійного мокротиння спостерігається при мікоплазмових пневмоніях, для яких також характерне відчуття садіння в горлі. Біль у боці, що посилюється при глибокому диханні та кашлі, характерна для крупозної пневмококової пневмонії, а також залучення до патологічного процесу плеври. При локалізації пневмонії в нижніх відділах легень та залученні до процесу діафрагмальної плеври біль може іррадіювати у черевну порожнину, симулюючи картину гострого живота. Якщо в процес залучений верхній або нижній язичковий сегмент лівої легені, болі локалізуються в серці. У 25% хворих скарга на задишку є однією з основних, особливо при пневмонії, що розвинулася на тлі хронічних захворювань органів дихання та серцевої недостатності. Виразність задишки наростає паралельно до порушення загального самопочуття. Симптоми вираженої інтоксикації найбільш характерні для корнітозної та мікоплазмової пневмоній, спостерігаються і при стафілококових, грипозних та пневмококових (крупозних) пневмоніях. Хворого можуть турбувати озноб та підвищення температури тіла до фебрильної. На загальному фоні інтоксикації та фебрильної температури з'являються місцеві симптоми. Діагностика. Для постановки етіологічного діагнозу має значення правильна оцінка симптомів захворювання на самому його початку. Осиплість голосу або неможливість розмовляти характерні для пневмоній, спричинених вірусом парагрипу. Сльозотеча, різь в очах, біль у горлі при ковтанні, рясне виділення з носа без зміни інших відділів дихальних шляхів зустрічаються при пневмоніях, спричинених аденовірусом. Найбільш значущим для діагнозу є наявність синдрому запальних змін легеневої тканини. Цей синдром становлять такі симптоми: 1) відставання при диханні ураженої сторони грудної клітки; 2) скорочення перкуторного звуку в області проекції ураження на більшому або меншому протязі; 3) посилення голосового тремтіння та бронхофонії у тій же зоні; 4) зміна характеру дихання (жорстке, бронхіальне, ослаблене тощо); 5) поява патологічних дихальних шумів (вологі дзвінкі хрипи і крепітація). Характер дихання може змінюватись по-різному. У початковій стадії крупозної пневмонії дихання може бути ослабленим, з подовженим видихом; у фазі печінки поряд із наростанням тупості перкуторного звуку прослуховується бронхіальне дихання; при вирішенні пневмонічного вогнища із зменшенням перкуторної тупості дихання стає жорстким. При осередковій пневмонії найбільш постійними симптомами є жорстке дихання та вологі дзвінкі хрипи. Однак при центральних прикореневих пневмоніях фізикальні дані представлені дуже мізерно, і розпізнавання пневмонії виявляється можливим лише після рентгенологічного дослідження. Убогістю фізикальних даних відрізняються мікоплазмові пневмонії. Тяжка інтоксикація у поєднанні з дуже малим числом хрипів спостерігається при пневмонії, спричиненій клебсієлою пневмонії. У ряді випадків при аускультації на перший план може виступати велика кількість басових та дискантних сухих хрипів, нехарактерних для синдрому запальної інфільтрації. Це трапляється при пневмоніях, що розвинулися на тлі хронічних бронхітів; пневмоніях, викликаних паличкою Пфейффера; у разі приєднання до пневмонії алергічного компонента. Поставити етіологічний діагноз допомагають симптоми: 1) виявлення дрібноплямистої, як при краснусі, висипки в поєднанні з лімфоаденопатією характерно для аденовірусної інфекції; 2) локальне збільшення лімфатичних вузлів говорить про перифокальну пневмонію; 3) грибкові пневмонії поєднуються з ураженням слизових оболонок, шкіри та нігтів; 4) гепатолієнальний синдром і невелика жовтяниця зустрічаються при корнітозних та куриккетсіозних пневмоніях; 5) для типових крупозних пневмоній характерний вид хворого: бліде обличчя з гарячковим рум'янцем на стороні поразки, герпетичні висипання, роздування крил носа при диханні. Найбільш важливим методом, що дозволяє уточнити наявність пневмонії та ступінь залучення до процесу легеневої тканини, є великокадрова флюорографія та рентгенологічне дослідження органів грудної клітки. Чіткою сегментарністю ураження легень із залученням до процесу декількох сегментів відрізняються стафілококові пневмонії. Їх характерною рентгенологічною ознакою є утворення на 5-7-й день від початку хвороби множинних порожнин у легенях типу пневмоцелі, а надалі – некротичних порожнин з наявністю рідини. На відміну від справжніх абсцесів конфігурація та кількість порожнин швидко змінюються. Пайова поразка - прояв крупозної пневмонії або пневмонії, викликаної клебсієллою. Частіше уражається верхня частка, переважно правої легені. Рентгенологічне дослідження дозволяє виявити випіт у плевральній порожнині. Часто такий випіт зустрічається при стрептококових пневмоніях, при пневмонії, спричиненій паличкою Пфейффера, яка локалізується в нижній частці та у 2/3 пацієнтів захоплює більше однієї частки легені. Особливо важливими є дані рентгенологічного обстеження при виявленні пневмонії зі слабко вираженими аускультативними змінами (інтерстиціальні та прикореневі пневмонії). У ряді випадків для уточнення діагнозу показано проведення томографії та бронхографії, які допомагають уточнити діагноз у випадках уповільненого зворотного розвитку інфільтративних змін, при ускладненій течії (абсцесі, випоті у плевральній порожнині). Вони застосовуються для виключення інших патологічних процесів із подібними клінічною та рентгенологічною картинами. Бронхографія виявляє порожнини розпаду в легеневій тканині, а також наявність бронхоектазів, навколо яких при загостренні можливі інфільтративні зміни (періфокальна пневмонія). У діагностиці інфарктної пневмонії певну роль грає радіонуклідне дослідження легеневого кровотоку, що виявляє порушення. Бактеріологічне дослідження мокротиння (або бронхіальних змивів) до призначення антибіотиків допомагає виявити збудник та визначити його чутливість до антибіотиків. Не завжди виявлений мікроорганізм є збудником пневмонії. Уточнений етіологічний діагноз може бути поставлений за допомогою імунологічних досліджень: реакції зв'язування комплементу (РСК) та реакції гальмування гемаглютинації (РТГА) з вірусними та бактеріальними антигенами. У діагностиці вірусних і вірусно-бактеріальних пневмоній мають значення вірусологічні та серологічні дослідження (результати культурального дослідження мокротиння, включаючи біологічну пробу на мишах, метод культивування вірусів у куриному ембріоні, що розвивається, метод імунофлюоресценції, серологічний метод з використанням парних сироваток проти вірусів -кратного наростання титру антитіл). Дослідження мокротиння допомагає уточнити природу пневмонії. Велика кількість еозинофілів свідчить про алергічні процеси, наявність атипових клітин – про пневмонію ракового генезу; мікобактерії туберкульозу виявляють при туберкульозі; еластичні волокна – свідчення розпаду легеневої тканини. При мікозних пневмоніях поряд з виявленням грибів відзначається відсутність гнійної флори внаслідок гнітючої дії продуктів життєдіяльності грибів. За даними мікроскопії мазків мокротиння, пофарбованих за Грамом, можна говорити про грамнегативні або грампозитивні мікроорганізми, що мешкають у бронхах вже в першу добу перебування хворого в стаціонарі. Про гостроту запального процесу судять за вираженістю острофазових показників крові та їх динаміки (лейкоцитоз зі зсувом лейкоцитарної формули, збільшення ШОЕ, підвищений вміст α2-глобулінів, фібриногену, поява СРВ, підвищення рівня сіалових кислот) При затяжному перебігу пневмонії та розвитку ускладнень вивчають імунологічну реактивність організму. Зниження показників гуморального (IgМ) та клітинного (затримка міграції лейкоцитів, зміна тестів, що характеризують систему Т-лімфоцитів) імунітету потребує проведення імуномодулюючої терапії. Лікування. Безпосередньо після встановлення діагнозу необхідно приступати до етіотропної терапії пневмонії. Велике значення набувають емпіричних уявлень про можливого збудника, оскільки бактеріологічне дослідження мокротиння проводиться протягом досить тривалого часу і у більшості хворих навіть при сучасному підході до цього дослідження дає невизначені, а іноді помилкові результати. На даний момент пеніциліни втратили своє значення як препарат вибору терапії пневмоній. Це пов'язано з тим, що етіологічно значущими для розвитку пневмоній, крім пневмокока та гемофільної палички, є облігатні внутрішньоклітинні мікроорганізми - Mycoplasma pneumoniae і Chlamydia pneumoniae, які стійкі до бактерицидного впливу антибіотиків групи β-лактамів. Не можна забувати і той факт, що до даних препаратів у пацієнтів швидко формується гіперчутливість. У зв'язку з вищесказаним у терапії пневмоній значну увагу приділяють макролідам, які довели свою ефективність не тільки проти пневмокока, а й щодо Mycoplasma pneumoniae, Chlarnydia pneumoniae. Однак важливо не забувати і про те, що еритроміцин, який є еталоном цієї групи препаратів через свою низьку стійкість у кислому середовищі (а отже, і низьку біодоступність), а також широку поширеність штамів пневмокока, резистентних до еритроміцину, втрачає своє клінічне значення. Як препарати вибору його змінили інші препарати класу макролідів - азитроміцин, рокситроміцин, роваміцин та ін. Ряд макролідів використовується і для перорального та парентерального застосування (наприклад, роваміцин). Як наслідок, виправдано їх застосування тяжкому перебігу запального процесу в легкому (наприклад, спочатку протягом 2-3 днів роваміцин призначається внутрішньовенно крапельно, а в подальшому, при позитивній динаміці патологічного процесу, пацієнт переходить на прийом препарату внутрішньо). Безперечна перевага роваміцину, оскільки, що він не вступає у взаємодію з теофілінами, при цьому запобігаючи можливості передозування цих препаратів, оскільки теофіліни та роваміцин використовуються спільно при лікуванні хворих з хронічними обструктивними захворюваннями легень. Відомо також, що підгрупа макролідів (16-членные макроліди) є препаратами з мінімальним рівнем побічних ефектів. У пацієнтів старше 65 років внаслідок неоднорідності етіологічного спектру пневмоній та при супутніх хронічних обструктивних захворюваннях легень напівсинтетичні пеніциліни можуть бути використані для ініціальної антибіотикотерапії, а за відсутності позитивного ефекту після даної терапії протягом 3-4 днів виправдане застосування цефало. Спектр дії цефалоспоринів I і деяких II покоління - це грампозитивні та грамнегативні мікроорганізми, а цефалоспорини III покоління діють в основному на грамнегативні збудники. I покоління цефалоспоринів представлене цефалотином (кефлін), цефазоліном (кефзол) та ін. До препаратів II покоління відносяться цефуроксим (кетоцеф), цефокситин (бонцефін) та ін. ). Аспіраційні пневмонії асоційовані з анаеробною або грамнегативною мікрофлорою, що визначає використання аміноглікозидів або цефалоспоринів III покоління у комплексі з метронідазолом-семісукцинатом (внутрішньовенно краплинно по 500 мг 2-3 рази на добу). Імунодефіцитні стани також впливають на характер вибраних препаратів, який при цьому залежить від природи збудника. У таких випадках застосована схема складається з аміноглікозидів та сучасних цефалоспоринів. Тривалість ефективної антибактеріальної терапії пацієнта з пневмонією – 7-10 діб. При призначенні лікування слід враховувати, що в 7-15% випадків можлива відсутність ефекту від даної терапії. Це свідчить про необхідність заміни антибіотиків, спираючись результати мікробіологічного дослідження. Іншим варіантом є використання альтернативних препаратів, про антибіотиків другого вибору: сучасні цефалоспорини, іміпенемом, монобактами, фторхінолони. Фторхінолони (офлоксацин, пефлоксацин, ципрофлоксацин) ефективні щодо грамнегативних збудників, включаючи Pseudomonas aeruginosa, та деяких грампозитивних коків (Staphylococcus aureus), проте неактивні при дії на анаероби. Фторхінолони виправдано можна розглядати як альтернативу макролідам при хламідіозній, легіонельозній та мікоплазмовій інфекціях. Монобактамні антибіотики в сучасному вигляді представлені азтреонамом (азактамом), який активний переважно щодо грамнегативних аеробів (сальмонели, шигели, протей, кишкова паличка, клебсієла та ін.); а також стійкий при дії β-лактамаз. Іміпенем - антибактеріальний препарат групи карбапенемів, що призначається тільки в комплексі з циластатином, що інгібує метаболізм іміпенему. Препарат високоефективний щодо багатьох анаеробів, грампозитивних коків та грамнегативних паличок. Дозування антибіотиків, що використовуються при лікуванні пневмоній. 1) Пеніциліни: бензилпеніцилін (500 000-1 000 000 ОД внутрішньовенно кожні 6-8 год або по 500 000-1 000 000 ОД кожні 4 години внутрішньом'язово), ампіцилін (0,5- 1,0-2,0 годин або 6 г кожні 8 годин внутрішньовенно), амоксицилін (0,5-6 г кожні 0,5 годин перорально або 1,0-8 г кожні 0,5-1,0 годин внутрішньом'язово, внутрішньовенно), оксацилін ( 8 г кожні 12-0,5 годин перорально, внутрішньом'язово, внутрішньовенно). 2) Цефалоспорини: I покоління - цефалотин (кефлін) (0,5-2,0 г кожні 4-6 год внутрішньом'язово, внутрішньовенно), цефазолін (кефзол) (0,5-2,0 г, кожні 8 год внутрішньом'язово, внутрішньовенно) ), ІІ покоління - цефуроксим (зінацеф, кетоцеф) (0,75-1,5 г кожні 6-8 год внутрішньом'язово, внутрішньовенно), ІІІ покоління - цефотаксим (клафоран) (1,0-2,0 г, максимально до 12 г/добу кожні 12 годин внутрішньом'язово, внутрішньовенно), цефтріаксон (лонгацеф, роцефін) (1,0-2,0-4,0 г кожні 24 год внутрішньом'язово, внутрішньовенно). 3) Аміноглікозиди: генетаміцин (80 мг кожні 12 год внутрішньом'язово, внутрішньовенно), амікацин (10-15 мг/кг кожні 12 год внутрішньом'язово, внутрішньовенно), тобраміцин (бруламіцин) (3-5 мг/кг кожні 8 год . 4) Макроліди: еритроміцин (0,5 г кожні 6-8 год перорально або 0,5-1,0 г кожні 6-8 год внутрішньовенно), роваміцин (3,0 млн. МО кожні 8-12 год перорально або 1,5, 3,0-8 млн. ME кожні 12-XNUMX год внутрішньовенно). 5) Фторхінолони: пефлоксацин (лефлацин) (400 мг кожні 12 год перорально, внутрішньовенно), ципрофлоксацин (ципробай) (500 мг кожні 12 год перорально або 200-400 мг кожні 12 год внутрішньовенно), кожні 200 год перорально). 6) Тетрацикліни: доксициклін (вібраміцин) (200 мг у 1-й день, у наступні дні – по 100 мг кожні 24 год перорально), міноциклін (міноцин) (200 мг у 1-й день, у наступні дні – по 100 мг кожні 12 год перорально), азтреонам (азактам) (1,0-2,0 г кожні 8-12 год), іміпенем/цилстатин (тієнам) (500 мг кожні 6-8 год внутрішньом'язово). Істотним є і той факт, що, як правило, затяжний або прогресуючий перебіг захворювання обумовлений неадекватною ініціальною антибактеріальною терапією. Однак, крім цього, виділяють ще низку місцевих та системних причин, які ведуть до тривалого та завзятого перебігу запалення в легенях: це локальна обструкція дихальних шляхів (рак, аденома, мукоїдна закупорка та ін.); бронхоектазія (вроджена, набута); кістозний фіброз; дефекти імунної системи (придбані); рецидивна аспірація (ахалазія, рак стравоходу та ін); активація латентної туберкульозної інфекції; абсцес легені, що формується; неадекватна антибактеріальна терапія ЛЕКЦІЯ № 9. Захворювання травного тракту. Хвороби стравоходу. Езофагіт та виразка стравоходу 1. Гострий езофагіт Гострий езофагіт - запальне ураження слизової оболонки стравоходу тривалістю від кількох днів до 2-3 місяців. Етіологія і патогенез. Етіологічні чинники: інфекційні захворювання, травми, опіки, отруєння, алергічні реакції, аліментарні похибки. З інфекційних агентів найбільш характерні для гострого езофагіту дифтерія, скарлатина, черевний та висипний тифи, грип, парагрип, аденовірусна інфекція, епідемічний паротит. Фізичні та хімічні фактори, що пошкоджують, представлені іонізуючою радіацією, хімічними опіками, гарячою і дуже холодною їжею, прянощами. Класифікація. Єдиної класифікації немає. Можливе застосування робочої класифікації гострих езофагітів. Морфологічно виділяють перелічені види гострого езофагіту: катаральний, набряковий, ерозивний, псевдомембранозний, геморагічний, зксфоліативний, некротичний, флегмонозний. За етіологією: інфекційний, хімічний, фізичний, аліментарний. За ендоскопічними стадіями: 1-я - набряк і гіперемія слизової, 2-я - поява одиночних ерозій на вершинах набрякових складок слизової оболонки, 3-я - значний набряк і гіперемія слизової оболонки з вогнищами ерозованої і кровоточивої слизової оболонки, 4-я - дифузно ерозована слизова оболонка, що кровоточить при найменшому дотику ендоскопа. клінічна картина. Катаральний езофагіт - найпоширеніша форма гострого езофагіту. Виникає на тлі похибок у харчуванні: при вживанні гострих, холодних, гарячих страв, при дрібних травмах, спиртових опіках. Клінічно проявляється печінням та болем за грудиною, які змушують хворих на кілька днів відмовлятися від їжі. Ендоскопічно відзначається езофагіт І-ІІ ступеня, рентгенологічно – гіперкінезія стравоходу. Ерозивний езофагіт виникає при інфекційних захворюваннях (фінне, висипному тифі, сепсисі, грибкових процесах) та алергозах. З'являється також при хімічних опіках та травмах стравоходу. Фактично, дана форма езофагіту є фазою еволюції катарального езофагіту. Основна клінічна картина складається із симптоматики основного захворювання. Клінічна симптоматика аналогічна така при катаральному езофагіті: значна вираженість болю за грудиною при проходженні їжі; печія, відрижка, гіперсалівація, гнильний запах із рота (какосмія). Ендоскопічно констатують ознаки езофагіту ІІ-ІІІ ступеня. При гістологічному дослідженні виявляються гіперемія, набряк слизової оболонки, крововиливу, ерозії. При рентгенологічному дослідженні спостерігаються велика кількість слизу в стравоході, перебудова рельєфу з утворенням плоских депо барію поздовжньої форми довжиною до 1 см і гіперкінезія стінок стравоходу. Геморагічний езофагіт - рідкісний клінічний різновид ерозивного езофагіту. Етіологія та сама, як і при ерозивному эзофагите. Клінічно типові інтенсивний больовий синдром та криваве блювання. Ендоскопія виявляє запалення III-IV ступеня з величезним переважанням геморагічного компонента. Відзначається відшарування слизової оболонки, що кровоточить, у вигляді вузьких тонких смуг. Фібринозний (псевдомембранозний) езофагіт. Етіологічними факторами при ньому є скарлатина, дифтерія, хвороби крові, грибкові захворювання, наслідки променевої терапії. У клініці превалюють дисфагія та інтенсивний больовий синдром, що посилюється після їжі, нудота, блювання. З блювотними масами виділяються плівки фібрину, можливо кровохаркання. Ендоскопічно на уражених ділянках слизової оболонки виявляються сірі та жовто-сірі фібринозні нальоти, утворені пластами фібрину та детриту, що покриває поверхню слизової оболонки. При відторгненні псевдомембран утворюються плоскі ерозії, що повільно гояться, іноді - виразки, що кровоточать. Після тяжкого інфекційного процесу у стравоході залишаються перетинчасті стенози, які зникають після повторного бужування. Мембранозний (ексфоліативний) езофагіт з етіології буває хімічним (опіки стравоходу), інфекційним (причинами є сепсис, оперізуючий лишай, натуральна віспа, генералізована герпетична інфекція). Клініка захворювання варіабельна – від легких форм, що діагностуються ендоскопічно, до тяжких. У клініці важкого мембранозного езофагіту переважають інтоксикація, дисфагія та больовий синдром. Можливі кровотечі, перфорації стравоходу, медіастиніт, які, як правило, закінчуються летальним кінцем. При ендоскопічному дослідженні спостерігається ураження всіх верств стравоходу, епітелій якого відкидається пластами. При стиханні основного захворювання стравоході іноді залишаються симетричні і асиметричні перетинчасті чи грубі рубцеві стенози. Некротичний езофагіт – рідкісна форма гострого запалення стравоходу. Його розвитку сприяють знижений імунітет при таких тяжких захворюваннях як сепсис, черевний тиф, кандидамікоз, термінальна стадія ниркової недостатності. Клініка характеризується хворобливою дисфагією, блюванням, загальною слабкістю, кровотечами, частим розвитком медіастиніту, плевриту, пневмонії. Після лікування основного захворювання у стравоході залишаються стриктури, що діагностуються як факультативні передракові зміни. Септичний езофагіт - рідкісне локальне або дифузне запалення стінок стравоходу стрептококової етіології або виникає при пошкодженні слизової оболонки стороннім тілом, при опіках, виразках, може переходити з сусідніх органів. Іноді зустрічається гострий флегмонозний езофагіт як ускладнення будь-якої форми гострого езофагіту, що призводить до гнійного розплавлення стінок стравоходу. Розпад стінок супроводжується проривом гною в клітковину середостіння, розвитком медіастиніту, плевриту, гнійного бронхіту, пневмонії, спондиліту, розривом аорти або інших магістральних судин. Приєднання анаеробної інфекції може призвести до емфіземи середостіння або спонтанного пневмотораксу. Клінічна картина характеризується вираженою інтоксикацією, високою температурою, болями за грудиною та в ділянці шиї, блюванням. При огляді відзначається припухлість у ділянці шиї, рухливість у цьому відділі хребта обмежена. Положення голови – вимушене, з нахилом в один бік. Захворювання нерідко трансформується у гнійний медіастиніт. В аналізах крові – гіперлейкоцитоз, прискорення ШОЕ. Інструментальне дослідження (рентгенологічне, ендоскопічне) на гострій стадії не показано. У період рубцювання рентгенологічне дослідження обов'язково у зв'язку з небезпекою розвитку грубих деформацій та рубцевих стенозів стравоходу. Лікування. Принципи лікування гострого езофагіту: етіотропне, патогенетичне та симптоматичне. Етіотропне лікування – лікування основного захворювання. При інфекційних захворюваннях, що ускладнилися гострим езофагітом, застосовують антибіотики (парентерально). При виражених некротичних та геморагічних змінах у стравоході рекомендовано утриматися від їди на 2-3 тижні. У цей період показано парентеральне харчування, внутрішньовенне введення білкових гідролізатів, сумішей амінокислот, інтраліпіду, вітамінів, дезінтоксикаційну терапію. Після зменшення запальних явищ призначають термічно та хімічно щадні продукти харчування: тепле молоко, вершки, овочеві супи, рідкі каші. Для зменшення місцевих симптомів запалення - внутрішньо розчини таніну 1%-ний, коларголу - 2%-ний, новокаїну - 1-2%-ний перед їжею. Приймають в'яжучі препарати в горизонтальному положенні з низько опущеним узголів'ям ліжка. За відсутності ефекту від місцевого прийому в'язких препаратів призначаються парентерально ненаркотичні анальгетики. Для зменшення явищ стравохідної дискінезії використовуються прокінетичні препарати (церукал, реглан, цизаприд) перед їжею. При множинних ерозіях показані препарати вісмуту (денол, вікар), ін'єкції солкосерилу. При геморагічному езофагіті, що ускладнився кровотечею, застосовують препарати амінокапронової кислоти, вікасол, діцинон. При масивному кровотечі призначають переливання крові чи плазми. При гнійних, некротичних езофагітах пацієнт довго повинен перебувати на парентеральному харчуванні, застосовується масивна терапія кількома антибіотиками, проводиться дренування гнійника. Корекція стриктур стравоходу здійснюється за допомогою їхнього бужування. В ексквізитних випадках накладається гастростома. Прогноз. Прогноз катарального та ерозивного езофагітів сприятливий. Можливе мимовільне зникнення симптомів езофагіту за умови адекватної корекції основного захворювання. Прогноз псевдомембранозного, екфоліативного, флегмонозного езофагітів серйозний. У всіх випадках за умови одужання від основного захворювання езофагіт закінчується утворенням рубцевих стриктур, які надалі вимагають корекції. Хворі з важкими формами езофагіту, що ускладнився стриктур стравоходу, непрацездатні. Профілактика гострих езофагітів полягає в адекватній та своєчасній діагностиці та лікуванні основного захворювання. 2. Хронічний езофагіт Хронічний езофагіт – хронічне запалення слизової оболонки стравоходу тривалістю до 6 місяців. Найбільш поширений варіант - пептичний езофагіт (рефлюкс-езофагіт), який може ускладнюватись пептичною виразкою стравоходу. Етіологія і патогенез. Головна причина захворювання – постійний рефлюкс у стравохід шлункового вмісту, іноді жовчі та кишкового вмісту, тобто пептичний езофагіт – це асептичний опік стравоходу кислотою шлунка. У патогенезі рефлюкс-езофагіту мають значення регургітація кислого вмісту та порушення очищення та спорожнення від нього стравоходу. Швидкість очищення стравоходу від хімічного подразнення називають кліренсом стравоходу. При нормальному кліренсі поодинокі закидання агресивних секретів не викликають рефлюкс-езофагіту. Гаряча їжа, алкоголь, куріння та інші екзогенні фактори знижують кліренс стравоходу. До таких факторів відноситься швидка їжа, при якій разом із їжею заковтується значна кількість повітря. Має значення і якість їжі: жирне м'ясо, сало, макаронні вироби, гострі приправи сприяють затримці евакуації їжі зі шлунка з наступним закиданням вмісту стравоходу. Істотно знижують тонус нижнього стравохідного сфінктера та сприяють рефлюксу лікарські препарати: антагоністи кальцію, нітрати, наркотичні анальгетики, холінолітичні препарати, теофілін та його аналоги, препарати з групи простагландинів. Існує п'ять критеріїв патогенності рефлюксу в генезі пептичного езофагіту: частота, об'єм, регургітація, хімічний склад, стан слизової оболонки стравоходу і чутливість до хімічного фактору (запалення стінок знижує чутливість), швидкість спорожнення (кліренс), що залежить в основному від активної слини та слизу. Виникненню рефлюкс-езофагіту сприяють грижі стравохідного отвору діафрагми, виразкова хвороба дванадцятипалої кишки, постгастрорезекційні порушення, алергози. Значення має і алергічна схильність. При морфологічному дослідженні у хворих на пептичний езофагіт відзначаються набряк, гіперемія слизової оболонки, інфільтрація підслизової оболонки наддіафрагмального сегмента стравоходу. Можливі два варіанти поширення хронічного запалення – тотальний та локальний рефлюкс-езофагіт. При залученні до більш ніж на 2/3 слизової стравоходу можливий розвиток рефлюкс-трахеїту, рефлюкс-бронхіту. На вершинах складок стравоходу виникають ерозії, дрібні виразки (у місцях максимального зрошення шлунковим вмістом). Хронічне запалення стравоходу призводить до виникнення спастичної контрактури та укорочення органу. клінічна картина. До типових ознак рефлюкс-езофагіту відносять печіння за грудиною, печію, відрижка, яке посилюються в положенні лежачи, дисфагію, позитивний ефект від прийому антацидів. Можуть виникати болі за грудиною після їди, що нагадують стенокардитичні. Виникнення болю при рефлюкс-езофагіті пов'язують з пептичним роздратуванням стінки стравоходу та його спазмами під час регургітації кислого шлункового вмісту, а також з утиском пролабованої слизової оболонки. Відмінні риси цього болю: тривалий, пекучий її характер, локалізація в ділянці мечоподібного відростка, іррадіація по ходу стравоходу, рідше – у ліву половину грудної клітки, відсутність помітного ефекту від прийому антацидів, спазмолітиків, посилення у горизонтальному положенні, особливо після їди. Особливу увагу в клінічній діагностиці слід приділяти малим симптомам дисфагії, таким як відчуття грудки за грудиною, відчуття проходження гарячої їжі стравоходом. Ознакою езофагіту, що поволі починається, можуть бути слинотеча і звичка запивати їжу водою. Фізичне обстеження пацієнтів із рефлюкс-езофагітом не дає діагностично значущої інформації. До ускладнень рефлюкс-езофагіту відносять кровотечі, виразки, стриктури, скорочення стравоходу, малігнізацію. Хронічний рефлюкс-езофагіт може призводити до розвитку аксіальної грижі стравохідного отвору діафрагми. Діагностика та диференціальний діагноз. Найбільш цінним методом досліджень при цій патології є ендоскопія, в ході якої відзначаються гіперемія, набряк, потовщення складок слизової оболонки. Достовірний покриває слизову оболонку білуватий наліт, який у початкових стадіях хвороби може бути тонким, ледь помітним, при тривалому процесі - масивним білим або брудно-сірим. На окремих ділянках на тлі білого нальоту нерідко видно яскраво-червону слизову оболонку стравоходу. У ряді випадків виявляються ерозивні та виразкові дефекти у вигляді смуг. Зміни слизової оболонки можуть відповідати будь-якій з чотирьох стадій езофагіту: від гіперемії до слизової оболонки, що "плаче". При вираженому езофагіті у просвіті накопичується багато слини та слизу. рН-метрія, на відміну ендоскопії, дає можливість об'єктивніше оцінити кліренс стравоходу. Рентгенологічно виявляють гастростравохідний рефлюкс. Диференціювати рефлюкс-езофагіт необхідно з виразковою хворобою шлунка та дванадцятипалої кишки, ішемічною хворобою серця, хронічним холециститом та панкреатитом. Провідним симптомом під час проведення диференціальної діагностики є біль. Диференціації з виразковою хворобою допомагають відсутність при езофагіті пізніх та "голодних" болів, а також дані, отримані при ендоскопії стравоходу та шлунка. Для коронарного болю, на відміну від езофагіту, характерні зв'язок з фізичним та емоційним навантаженням, ефект від нітратів, ознаки ішемії на ЕКГ, у тому числі і за даними велоергометрії. Дані УЗД органів черевної порожнини допомагають виключити патологію жовчного міхура та підшлункової залози як причину больового синдрому. Лікування. Терапія рефлюкс-езофагіту включає лікування захворювань, що його викликали, і призначення антирефлюксної терапії. Пацієнтам рекомендують виключити підйом ваг, нахили. Необхідно приймати правильне положення під час відпочинку та сну (підголів'я на 15-20 см, під кутом 30-50 °). Рекомендується нормалізувати масу тіла, харчуватися дрібно (останній прийом їжі - за 3 години до сну). З раціону виключають алкоголь, гострі страви. Призначають адсорбенти та олужнюючі препарати, що надають протективну дію на слизову оболонку. До таких речовин відноситься вентер, який призначають внутрішньо по 1 г (краще у вигляді суспензії) за 30-40 хв до їди 3 рази на день і 4-й раз – натще перед сном. Курс лікування – 8-10 тижнів. Аналогічну дію мають алмагель, фосфалюгель, маалокс, гастал. Ці препарати застосовують у міжтравний період (через 1/2-2 год після їди та на ніч) до настання повної ремісії. Фосфалюгель і маалокс призначають по 1-2 пакети 2-3 рази на добу, гастал - по 2-3 таблетки на добу. Чайну соду, суміш Бурже, білу глину у зв'язку з недостатньою ефективністю застосовувати недоцільно. Обволікаючу та в'яжучу дію надає нітрат вісмуту по 1 г 3-4 рази на день. Відзначено високу антирефлюксну активність нового антациду - топалкану. Вилужуючий ефект мають мінеральні води - "Боржомі", "Єсентуки № 4", "Джермук", "Смирновська". Для зменшення кислої шлункової секреції призначають блокатори Н2-рецепторів гістаміну (циметидин, ранітидин, фамотидин), інгібітори Ка-К-АТФази (омепразол), селективний блокатор М-холінорецепторів клітин обкладинки, його аналог бускопан. Циметидин призначають по 400 мг 2 десь у день, ранитидин - по 300 мг і фамотидин - по 40 мг одноразово ввечері після вечері. Омепразол рекомендується при резистентних формах ерозивно-виразкового рефлюкс-езофагіту. Його призначають по 30-40 мг на добу на 3-4 тижні. Для нормалізації моторно-евакуаторних порушень при рефлюксній хворобі призначають метоклопрамід (церукал, реглан, перинорм, біомрал), препульсид (сайзепрайд, мотиліум, домперидон, координакс). Метоклопрамід та його аналоги 2-го покоління підвищують тонус нижнього стравохідного сфінктера, знижують внутрішньошлунковий тиск, прискорюють евакуацію зі шлунка. Призначають метоклопрамід по 1 таблетці 3-4 рази на день перед їжею або по 2 мл внутрішньом'язово 2 рази на день. Препарат зазвичай добре переноситься. При його застосуванні можлива сухість у роті, сонливість, шум у вухах, які зменшуються після їди. Сайзеприд є новим гастроінтестинальним прокінетичним засобом. Він підвищує тонус нижнього стравохідного сфінктера, покращує стравохідний кліренс, посилює моторноевакуаторну функцію травного тракту, пригнічує патологічні рефлюкси (шлунково-стравохідний та дуоденогастральний). Препарат, на відміну від метоклопраміду, не блокує донамінові рецептори, не є прямим стимулятором холінолітичних рецепторів, позбавлений побічних ефектів, властивих церукалу та його аналогам. Його призначають внутрішньо по 5 або 10 мг 2-3 рази на добу. Курс лікування продовжується від 2-3 тижнів до 2-3 місяців. Цезаприд при рефлюкс-езофагіті може застосовуватися як засіб монотерапії. Прогноз і профілактика. Прогноз для життя та трудової діяльності сприятливий. При ускладненому перебігу прогноз визначається своєчасністю та якістю надання медичної допомоги. Пацієнтам з тяжким перебігом встановлюється група інвалідності. Хворі з хронічним рефлюкс-езофагітом повинні перебувати під наглядом гастроентеролога. Не рідше 2 разів на рік показані ендоскопічні та морфологічні дослідження у зв'язку з можливістю малігнізації. 3. Виразка стравоходу Виразка стравоходу - гостре або хронічне захворювання, що характеризується виразкою слизової оболонки дистального відрізка стравоходу під впливом активного шлункового соку. Етіологія і патогенез. Хронічні пептичні виразки стравоходу є ускладненнями рефлюкс-езофагіту та хіатальної грижі. Їх виникненню сприяють внутрішній короткий стравохід, осередкова метаплазія слизової оболонки, гетеротопія слизової оболонки шлунка в стравохід, рефлюксна хвороба при недостатності кардії, захворювання, що супроводжуються частою блювотою (постваготомічний синдром, синдром петлі, хронічний алкоголізм). Гострі виразки стравоходу можливі при патологічній сухості слизової оболонки стравоходу (ксерозі), медикаментозних алергозах, при вживанні НПЗЗ, мікозах, вірусних інфекціях, шкірних опіках та хворобах ЦНС. Ці виразки сприймаються як симптоматичні. клінічна картина. У частини пацієнтів відзначається поєднане виразкове ураження слизової оболонки стравоходу та гастродуоденальної зони. Симптоми виразки стравоходу нагадують клініку пептичного езофагіту: завзята печія, що посилюється після їжі, при нахилі тулуба, в положенні лежачи, виникають відрижка, біль при ковтанні, порушення проходження твердої їжі. Ускладнення, типові виразок стравоходу: перфорація, кровотеча, пенетрація, стриктура. Кровотеча проявляється кривавим блюванням, меленою, гіпохромною анемією, падінням серцевої діяльності. Перфорація стравоходу діагностується дуже рідко. Клінічні симптоми перфорації не відрізняються від симптомів гострої проникаючої та непроникаючої механічної травми сторонніми тілами. Пенетрують в навколишні тканини приблизно 14% виразок стравоходу. Діагностика та диференціальний діагноз. За клінічними симптомами запідозрити виразку пептики вкрай важко. Діагноз верифікується в ході інструментального та лабораторного дослідження. Найбільш інформативно рентгенологічне та ендоскопічне дослідження. Рентгенологічно виразка є нішою в супракардіальному відділі стравоходу з невеликим перифокальним набряком слизової оболонки. Стравохід у сфері виразки спастично скорочений, з нього визначається невелике супрастенотичне розширення. Виразку супроводжують ознаки гіперкінезії та рефлюкс-езофагіту, дуже часто зустрічаються симптоми хіатальної грижі. Іноді виразка нагадує невеликий епіфренальний дивертикул, проте останній не має типового клінічного перебігу, не поєднується з недостатністю кардії, грижами, езофагітом. Важче за рентгенологічними ознаками відрізнити пептичну виразку стравоходу від виразкового ендофітного раку, який супроводжується ригідністю стінок та рельєфу слизової оболонки, асиметричним валом. Найбільш достовірні відомості у верифікації виразки стравоходу дають ендоскопія і множинна біопсія з країв виразки. При просуванні ендоскопу до виразки виявляються ознаки езофагіту I-IV стадії, моторна дисфункція стравоходу, перифокальний набряк і гіперемія слизової оболонки. Гостра виразка зазвичай кругла або овальна, з крутими краями, покрита білуватим або зеленим нальотом. Хронічна виразка має рівне дно із щільними та нерівними стінками, пологими краями, гнійно-фібринозними нальотами, вогнищами грануляцій та рубцевих накладень. Для виключення малігнізації беруть 4-6 біоптатів із країв виразки. При ендоскопічному дослідженні виявляють поодинокі пептичні дефекти, витягнуті по осі стравоходу. Довжина їх варіює в межах 1-10 см, але частіше не перевищує 1 см. Виразка частіше неглибока, дно її вкрите білявим нальотом. Гіперемія, набряк слизової та поодинокі ерозії нерідко відображають помірну перифокальну запальну реакцію. Після загоєння виразки в стравоході залишаються грубий лінійний або зірчастий рубець або груба дивертикулоподібна деформація стінки і звуження просвіту. Слід диференціювати пептичні виразки стравоходу з виразками специфічного характеру (при туберкульозі, сифілісі). У цих ситуаціях суттєво допомагають специфічні серологічні тести, результати гістологічного та бактеріологічного досліджень. Поєднання патології стравоходу з ураженням легень та інших органів змушує цілеспрямовано обстежити хворого щодо специфічного процесу. Лікування. Лікування включає призначення дієти: рекомендується механічно та хімічно щадна їжа, яка приймається невеликими порціями 5-6 разів на день. Для запобігання рефлюксу вмісту зі шлунка в стравохід положення хворого в ліжку має бути з піднятим узголів'ям. Медикаменти приймають лежачи. Призначають монотерапію препаратом однієї з наступних фармакологічних груп: антисекреторні, у тому числі антациди та адсорбенти, стимулятори моторно-евакуаторної функції шлунка (прокінетики), препарати – імітатори слизу. Терапія здійснюється тривало – 1,5-3 місяці. Показання до хірургічного лікування – відсутність загоєння протягом 6-9 місяців, ускладнений перебіг (перфорація, пенетрація, стеноз, кровотеча). Прогноз і профілактика. Перебіг захворювання рецидивує. Прогноз для життя та трудової діяльності сприятливий. Рекомендується періодичне (1-2 рази на рік) обстеження в амбулаторних умовах у гастроентеролога із застосуванням ендоскопії та біопсії. Проводиться сезонна (весна – осінь) профілактика рефлюкс-езофагіту. ЛЕКЦІЯ № 10. Захворювання травного тракту. Хвороби шлунка. Хронічний гастрит Хронічний гастрит – це захворювання, яке клінічно характеризується шлунковою диспепсією, а морфологічно – запальними та дистрофічними змінами слизової оболонки шлунка, порушенням процесів клітинного оновлення, збільшенням числа плазматичних клітин та лімфоцитів у власній мембрані слизової оболонки. Етіологія і патогенез. На етапі розвитку гастроентерології встановлено, що появі хронічного гастриту сприяє мікробна експансія Helicobacter pylori (НР), що у 95 % випадків викликає антральний гастрит й у 56 % - пангастрит. У свою чергу, так звані етіологічні фактори виникнення хронічного гастриту можна з великою часткою впевненості віднести до факторів ризику (нерегулярне незбалансоване харчування, куріння, прийом алкоголю, гіперсекреція соляної кислоти та пепсину). Провідна роль у розвитку захворювання також належить аутоімунним механізмам, що супроводжуються накопиченням антитіл до парієтальних клітин слизової оболонки шлунка, обтяженої спадковості, а також прийому медикаментів, що надають шкідливу дію на слизову оболонку шлунка. Класифікація. У 1990 р. на IX Міжнародному конгресі гастроентерологів в Австралії було прийнято нову систематизацію хронічного гастриту, названу Сіднейською системою. Гістологічні засади класифікації. 1) Етіологія: хронічний гастрит, що асоціюється з НР, аутоімунний, ідіопатичний, гострий медикаментозний гастрит. 2) Топографія: антральний, фундальний, пангастрит. 3) Морфологія: гострий, хронічний, особливі форми. Ендоскопічні основи класифікації: 1) гастрит антрального відділу шлунка; 2) гастрит тіла шлунка; 3) пангастрит; 4) зміни слизової оболонки шлунка: набряк, еритема, ранимість слизової оболонки, ексудат, плоскі ерозії, підняті ерозії, гіперплазія складок, атрофія складок, видимість судинного малюнка, надслизові крововиливи. клінічна картина. Хронічний гастрит – одне з найпоширеніших захворювань у клініці внутрішніх хвороб. Його частота у мешканців земної кулі коливається в межах від 28 до 75%. Хронічний гастрит частіше проявляється симптомами шлункової диспепсії та болем в епігастральній ділянці. Рідше він протікає безсимптомно. Біль зазвичай локалізується в епігастральній ділянці. Простежується чіткий зв'язок її виникнення з прийомом їжі та локалізацією запального процесу у шлунку. У хворих з гастритом субкардіального та кардіального відділів шлунка біль в епігастральній ділянці виникає через 10-15 хв після їди, при патології тіла шлунка - через 40-50 хв після їди. "Пізні", "голодні", болі типові для гастриту вихідного відділу шлунка, або дуоденіту. "Двохвильовий" біль - після прийому їжі та натщесерце - спостерігається при гастриті субкардіального та антрального відділів. При дифузному процесі болі локалізуються в надчеревній ділянці, виникають після їжі і носять давить. Про безсимптомному перебігу гастриту говорять, коли встановити взаємозв'язок болю в епігастральній ділянці та вогнища ураження не є можливим, що має місце при його ендогенному походженні (гастрит стає вторинним по відношенню до патології інших органів та систем). Не менш важливе місце в клінічній картині хронічного гастриту займає диспепсичний синдром: нудота, відрижка (кислим, гірким, тухлим), печія, запор або пронос, нестійкий стілець. При ізольованому антральному гастриті першорядними стають скарги на печію та запор, що виникають внаслідок гіперсекреції соляної кислоти та пепсину. При пангастриті з ознаками вираженої атрофії переважають нудота, відрижка "тухлим", нестійкий випорожнення або пронос, що характерно для гіпосекреції соляної кислоти та пепсину. Завзята нудота характерна для вторинного гастриту при хронічному панкреатиті, хронічному холецистит, що протікає з гіпомоторною дискінезією жовчного міхура. Діагностика. Хронічний гастрит тече тривало, з наростанням симптоматики з часом. Загострення провокуються аліментарними порушеннями. Фізика картина хронічного гастриту досить мізерна. У 80-90% хворих під час загострення захворювання при об'єктивному дослідженні визначається лише локальна болючість в епігастральній ділянці. При поєднанні хронічного гастриту з дуоденітом, холецистит або панкреатитом може визначатися не типова для гастриту локалізація болю, але властива патології іншого органу. Загальні аналізи крові та сечі, біохімічні показники крові у хворих на хронічний гастрит не відрізняються від відповідних показників у здорових осіб. При копрологічному дослідженні змін в аналізах немає або можуть бути ознаки порушення травлення. При вивченні шлункового вмісту кислотовиділення методом рН-метрії відзначаються ознаки гіперсекреції кислоти, так і явища зниження кислотної продукції. Показники пепсинутворення при хронічному гастриті стійкіші і знижуються на фоні стійкої анацидності при дифузному ураженні органу. Рентгенологічне обстеження швидше дозволяє виключити інші захворювання шлунка (виразку, рак), допомогти у діагностиці хвороби Менетріє, ніж підтвердить діагноз хронічного гастриту. Через мізерність клінічних проявів захворювання, а також неспецифічність лабораторних досліджень діагноз хронічного гастриту базується на результатах ендоскопічного та морфологічного дослідження. Ендоскопія виявляє різну вираженість зміни слизової оболонки шлунка: набряк, еритема, ранимість слизової оболонки, ексудат, плоскі ерозії, підняті ерозії, гіперплазія або атрофія складок, видимість судинного малюнка, підслизові крововиливи. Про хронічний гастрит говорять зі збільшенням числа плазматичних клітин та лімфоцитів у власній мембрані слизової оболонки (на відміну від гострого гастриту, коли з'являються поліморфно-ядерні лейкоцити). У зв'язку з викладеним вище морфологічна ідентифікація запалення при гастриті може не збігатися з інтерпретацією даних клініциста. Активність запальних змін слизової оболонки шлунка оцінюється морфологічно та морфометрично за рівнем лейкоцитарної інфільтрації власної платівки чи епітелію. Не можна не брати до уваги той факт, що аутоімунні гастрити не бувають активними. Морфологічні зміни (слабкі, помірні та важкі) – запалення, активність, атрофія, метаплазія – та ступінь обсіменіння НР оцінюють кількісно. Клінічні прояви, властиві гастриту, спостерігаються при інших захворюваннях органів травлення, тому в процесі діагностики необхідні УЗД черевної порожнини, ретельне ендоскопічне та морфологічне дослідження органів травлення. Диференціальна діагностика. Найважчою є диференціальна діагностика гастриту з функціональними захворюваннями шлунка, виразковою хворобою шлунка та дванадцятипалої кишки, хронічним холециститом та панкреатитом та раком шлунка. Функціональні захворювання шлунка аналогічно хронічному гастриту можуть протікати латентно або супроводжуватися болем та диспепсичними явищами. Вони характеризуються невеликою тривалістю, наявністю загальноневротичних симптомів, що переважають у клінічній картині захворювання (таких як слабкість, підвищена стомлюваність, дратівливість, біль голови, нестійкий настрій, пітливість). При розладах функції шлунка біль не залежить від якості їжі або виникає після вживання строго певного продукту. Часто спостерігається синдром ацидизму (печія, кисла відрижка, кислий смак у роті), який, на відміну від гастриту з підвищеною секреторною функцією, посилюється не після їжі, а при хвилюванні, тривалих перервах у їжі. Блювота при функціональних патологіях шлунка розвивається за механізмом умовного рефлексу, приносить хворому полегшення та не призводить до значного погіршення загального стану. При хронічному гастриті вона зазвичай виникає під час загострення і приносить полегшення хворому. Найчастішим симптомом порушень функції шлунка є гучна відрижка повітрям. При хронічному гастриті вона пов'язана з порушенням перетравлення їжі або моторикою шлунка і може бути кислою, якщо збережена секреція, або з запахом тухлих яєць - при її зниженні. При дослідженні шлункової секреції при гастритах виявляють на початку захворювання нормальні величини секреції, а надалі тенденцію до зменшення виділення шлункового соку. При функціональних захворюваннях шлунка часто спостерігається гетерохілія. Рентгенологічне дослідження шлунка дає змогу підтвердити такі форми гастриту, як ригідний, ангральний, гігантський гіперпластичний, поліпозний, а при порушеннях моторно-евакуаторної функції шлунка (гастротропоз, гіпотонія) вказує на функціональний характер захворювання. Найбільш цінним методом дослідження для диференціальної діагностики хронічного гастриту та функціональних захворювань шлунка є гастроскопія, яка дозволяє у спірних випадках констатувати зміни слизової оболонки шлунка, характерні для гастриту чи функціональних захворювань шлунка. Диференціальний діагноз хронічного гастриту з виразковою хворобою описаний у наступній лекції. Рак шлунка має дуже подібну картину з гастритом зі зниженою секреторною функцією. Рання діагностика раку шлунка на підставі клінічних ознак скрутна, особливо у хворих, які тривалий час страждають на гастрит. Велике значення для діагностики раку мають появу стійкого завзятого болю, що мало залежить від прийому їжі, невмотивованої загальної слабкості та підвищеної стомлюваності, збочення апетиту, а також прогресуюче зменшення маси тіла хворого. Виявлення пухлини при пальпації відноситься до пізніх стадій ракового процесу. Такі симптоми, як зміна самопочуття хворого, швидке зниження кислотності шлункового соку, дефіцит соляної кислоти, поява атипових клітин у шлунковому соку, позитивна реакція на приховану кров у калі повинні викликати у лікаря підозру на рак шлунка. Вирішальне значення при диференціальній діагностиці мають рентгенологічне та гастроскопічне дослідження з прицільною біопсією слизової оболонки шлунка. У хворих на хронічний гастрит зі зниженою секреторною функцією при рентгенологічному дослідженні виявляють атрофію його слизової оболонки, що підтверджує і гастроскопія. При прицільній біопсії у таких випадках виявляють структурну перебудову та атрофію слизової оболонки. Для раку шлунка при рентгенологічному дослідженні характерні наявність дефекту наповнення, відсутність складок слизової оболонки або зміна їхнього характеру та відсутність перистальтики на окремих ділянках. Ендоскопія шлунка дає можливість виявити пухлину на ранньому етапі її розвитку, коли пухлина знаходиться ще в межах слизової оболонки шлунка, а оперативне лікування більш ніж у 90% випадків призводить до одужання. Хронічний холецистит. При хронічному холециститі біль локалізується в області правого підребер'я та має тупий характер. При калькульозному холециститі біль гострий колікоподібний, з іррадіацією в праву підлопаткову область. Виникнення болю пов'язане з прийомом жирної їжі або тряскою їздою. При хронічному гастриті біль у надчерев'ї розлитий, тупий, іррадіації не буває, він виникає відразу після їжі всухом'ятку або при порушенні режиму харчування. При гастриті та холециститі біль супроводжується диспепсичними явищами, але почуття тяжкості у надчерев'ї, розпирання, відрижка їжею чи повітрям, металевий смак у роті більш характерні для гастриту. Блювота при хронічному гастриті спостерігається рідко. Об'єктивно при хронічному холециститі, особливо калькульозному, виявляють напругу передньої черевної стінки, гіперестезію шкіри у правому підребер'ї, що нехарактерно для хронічного гастриту. При пальпації живота у разі хронічного холециститу відзначають болючість у сфері локалізації жовчного міхура. Для хронічного гастриту характерна розлита болючість. У хворих з хронічним холециститом при дослідженні жовчі виявляють збільшення кількості слизу та лейкоцитів. Для хронічного гастриту характерна нормальна картина жовчі на тлі змін секреції та кислотності шлункового соку, а також інших функцій шлунка (всмоктувальної, моторної). При рентгенологічному дослідженні жовчного міхура у хворих на хронічний холецистит виявляють зміну його евакуаторної функції, а також конкременти. Хронічний панкреатит. При хронічному панкреатиті біль локалізується у лівій половині живота, іррадіює у ліву підлопаткову ділянку, у поперек, що оперізує. Виникнення болю пов'язане із вживанням рясної, часто жирної їжі, алкоголю. Якщо для хронічного гастриту характерний тривалий, монотонний перебіг захворювання, то при хронічному панкреатиті воно ступенеподібне. При об'єктивному дослідженні у разі хронічного панкреатиту виявляють гіперестезію шкіри у лівому підребер'ї, болючість топографічно відповідає розташуванню підшлункової залози. При лабораторному дослідженні соку підшлункової залози при хронічному панкреатиті виявляють стійку зміну лужності та ферментів: у крові та сечі може змінюватися рівень діастази, чого немає при хронічному гастриті. Рентгенологічно для хронічного панкреатиту характерні збільшений розворот кільця дванадцятипалої кишки, різке збільшення її великого сосочка (симптом Фростберга), іноді наявність ділянок звапніння підшлункової залози. Слід проводити також інтранозологічну діагностику різних форм хронічного гастриту. Так, захворювання, асоційоване з НР, клінічно протікає з симптоматикою виразки дуоденальної, а в ряді випадків може протікати латентно. При ендоскопічному та морфологічному дослідженні виявляється антропілородуоденіт. Ерозії при хелікобактерному гастриті локалізуються зазвичай у ділянці вираженого запалення (антропілорічній зоні шлунка). Аутоімунний хронічний гастрит клінічно характеризується відчуттям тяжкості в епігастральній ділянці, неприємним присмаком у роті, відрижкою тухлим, нудотою. Внаслідок недостатньої продукції соляної кислоти з'являються проноси. У 10% випадків на тлі аутоімунного гастриту виявляються симптоми В12-дефіцитної анемії: слабкість, блідість шкіри та слизових, ламкість нігтів, в аналізах крові – гіперхромна мегалобластична анемія. До особливих форм захворювання належать гранулематозний, еозинофільний, гіпертрофічний (хвороба Менетріє), лімфоцитарний гастрити. Гранулематозний гастрит виступає як самостійна форма захворювання або частіше – одна із складових більш серйозної патології (хвороби Крона, туберкульозу, саркоїдозу). Діагноз завжди підтверджуєте результатами гістологічного дослідження біоптатів слизової оболонки шлунка. Еозинофільний гастрит зустрічається вкрай рідко та обумовлений системним васкулітом. В анамнезі обов'язкове наявність алергічних реакцій. При гістологічному дослідженні виявляють еозинофільну інфільтрацію слизової оболонки шлунка. Гіпертрофічний гастрит (хвороба Менетріє) клінічно проявляється болями в епігастральній ділянці та нудотою. У частини хворих може спостерігатися зниження маси тіла внаслідок проносу. При ендоскопічному, рентгенологічному та морфологічному дослідженнях знаходять гігантські гіпертрофовані складки слизової оболонки, що нагадують звивини головного мозку. Лімфоцитарний гастрит клінічно протікає малосимптомно; морфологічно ця форма характеризується вираженою інфільтрацією слизової оболонки шлунка лімфоцитами. Лікування. Хворі на гастрит потребують заходів загальномедичного характеру: регулярного збалансованого харчування, нормалізації режиму праці та відпочинку, нівелювання стресових ситуацій побутового та виробничого плану. Медикаментозна терапія показана лише за наявності клінічних проявів хронічного гастриту. Хворі на гастрит, асоційований з НР, лікуються за програмою виразкової хвороби (див. наступну лекцію). Особи з аутоімунним гастритом потребують призначення вітаміну В12 (по 500 мкг 1 раз на день підшкірно протягом 30 днів з наступним повторенням курсів лікування), фолієвої кислоти (по 5 мг на добу), аскорбінової кислоти (до 1 г на добу). За необхідності проводиться замісна терапія ферментними препаратами (мезим-форте, фесталом, ензисталом, креоном, панцитратом, ацидин-пепсином). Больовий синдром зазвичай усувають призначенням антацидів (маалоксом, алмагелем, гасталом) або блокаторів Н-гістамінорецепторів (ранитидину, фамотидину) у середніх терапевтичних дозах. При особливих формах гастриту потрібне лікування основного захворювання. Прогноз і профілактика. Прогноз для життя та трудової діяльності сприятливий. Хворі з хронічним гастритом повинні перебувати на обліку у гастроентеролога. Їх обстежують клінічно та ендоскопічно з біопсією не рідше 1 разу на рік для виключення пухлинної трансформації. Найбільш небезпечні у плані ракового переродження гіпертрофічний, дифузний атрофічний гастрит із дисплазією епітелію. При ускладнених кровотечею ерозивних формах хвороби, а також при декоменпенсованій формі хвороби Менетріє прогноз визначається своєчасністю та адекватністю хірургічного лікування. Профілактика гастриту зводиться до раціонального харчування, дотримання режиму праці та відпочинку, обмеження прийому НПЗЗ. ЛЕКЦІЯ № 11. Захворювання травного тракту. Хвороби шлунка. Виразкова хвороба Виразкова хвороба (пептична виразка) - хронічне, рецидивне захворювання, що клінічно проявляється функціональною патологією гастродуоденальної зони, а морфологічно - порушенням цілісності її слизового та підслизового шарів, у зв'язку з чим виразковий дефект завжди гоїться з утворенням рубця. Етіологія. Основним етіологічним чинником виразкової хвороби є мікробна експансія НР лежить на поверхні епітелію шлунка. Значення бактеріальної агресії в етіології захворювання вивчається з 1983 р., коли Дж. Уоррен та Б. Маршалл повідомили про виявлення великої кількості S-спіралеподібних бактерій на поверхні епітелію антрального відділу шлунка. Хелікобактерії здатні існувати в кислому середовищі завдяки продукції ферменту уреази, що перетворює сечовину (з кровоносного русла) на аміак та вуглекислий газ. Продукти ферментативного гідролізу нейтралізують соляну кислоту та створюють умови для зміни рН середовища навколо кожної бактеріальної клітини, таким чином забезпечуються сприятливі умови для життєдіяльності мікроорганізмів. На поверхні епітеліальних клітин шлунка відбувається тотальна колонізація НР, що супроводжується ушкодженням епітелію під дією фосфоліпазу. Останні забезпечують утворення з жовчі токсичних лецитинів та протеїназ, що викликають деструкцію захисних білкових комплексів та слизу. На тлі "залужування" мембран епітеліоцитів аміаком змінюється мембранний потенціал клітин, посилюються зворотна дифузія іонів водню, загибель і злущування епітелію слизової оболонки шлунка. Всі ці зміни призводять до проникнення НР углиб слизової оболонки шлунка. Не менш важливими у розвитку виразки є нервово-психічні впливи, спадкова схильність, інфекційні агенти, аліментарні похибки та прийом деяких медикаментів, шкідливі звички. Вперше неврогенну концепцію виникнення захворювання сформулював Bergman, який стверджував, що спадково-конституційні порушення з боку вегетативної нервової системи призводять до спазму мускулатури та судин у стінці шлунка, ішемії, зниження резистентності слизової оболонки до агресивної дії шлункового. Цю теорію надалі розвинули К. Н. Биков та І. Т. Курцин (1952 р.). Вони обґрунтували кортиковісцеральну теорію ульцерогенезу, в основі якої лежать дані про зміни у вищій нервовій діяльності, що виникають внаслідок хронічної нервово-психічної травматизації. Доповнена та деталізована вченням про біохімічні та гормональні ланки регулювання шлункової секреції, моторики та трофіки, дана теорія ульцерогенезу в останні роки знову завоювала багато прихильників. Популярністю серед дослідників користуються спадкові фактори: інертність основних нервових процесів, групоспецифічні властивості крові, імунологічні та біохімічні особливості, синдром спадкової обтяженості. У виникненні виразкової хвороби значне значення надавалося аліментарним порушенням. Однак проведені в останні два десятиліття клініко-експериментальні дослідження в більшості випадків не виявили шкідливої дії харчових продуктів на слизову оболонку гастродуоденальної області. Поширеність виразкової хвороби серед значних контингентів осіб із різним характером харчування також свідчить проти провідного значення аліментарних факторів. Істотне значення для виникнення виразки мають порушення ритму та регулярності харчування, великі перерви між прийомами їжі, несвоєчасність її прийняття. Дослідники висловлюють відносно суперечливі погляди щодо ролі алкоголю у ульцерогенезі. Відомо, що алкоголь спричиняє атрофічні зміни слизової оболонки шлунка. Ці спостереження перебувають у суперечності із загальною концепцією виразкоутворення. Проте часте вживання алкоголю супроводжується порушеннями режиму харчування, якісними змінами складу їжі, що може викликати виразкову хворобу шлунка і дванадцятипалої кишки. Активно вивчається роль лікарських впливів у ульцерогенезі. Опубліковані в літературі результати досліджень та власні дані свідчать про те, що найбільш вираженими ульцерогенними властивостями володіють нестероїдні протизапальні засоби та глюкокортикоїдні гормони. Патогенез. Патогенез виразкової хвороби досі не до кінця вивчений. При розгляді процесів ульцерогенезу необхідно виділити низку постулатів: 1) характерна сезонність загострень виразкової хвороби; 2) відзначається переважна локалізація пептичних виразок в антропілородуоденальній зоні; 3) відзначено наявність соляної кислоти та пепсину у шлунковому соку; 4) помітна висока частота (до 70%) мимовільного загоєння виразок шлунка та дванадцятипалої кишки; 5) є хронічний антральний гастрит, асоційований з НР; 6) антропілорична частина шлунка та початкова частина дванадцятипалої кишки, є "гіпоталамусом" шлунково-кишкового тракту; 7) має місце спадкова схильність до виникнення пептичної виразки; 8) виникнення виразки, її рецидивування та ремісії можливі за наявності всіх вищевказаних факторів. Таким чином, єдина концепція ульцерогенезу є такою. У хворого зі спадковою схильністю до виразкової хвороби за наявності хронічного бактеріального гастриту в період осіннього або весняного дисгормонозу відзначаються лише гіперплазія та гіперфункція ендокринних клітин, що секретують гастрин, гістамін, мелатонін та серотонін. Основні гормони та біогенні аміни, що продукуються антропилорудуоденальною зоною, беруть участь як у стимуляції шлункової секреції, так і змінюють трофіку та проліферацію клітин насамперед у даній зоні. На тлі активного бактеріального гастриту та дуоденіту виникають сприятливі умови для виразки. p align="justify"> При формуванні пептичного дефекту функціональна активність ендокринних клітин знижується. Це веде до зменшення кислотно-пептичної агресії, поліпшення трофіки тканини в антропілородуоденальній зоні і створення умов для загоєння виразки шлунка і дванадцятипалої кишки навіть на тлі мікробної експансії НР, що триває. В гострому періоді виразкової хвороби відзначається гіперплазія α-ендорфінпродуцірующх клітин, що відносяться до універсальних цитопротекторів. Саме вони виступають як основні захисні механізми при пептичній виразці та забезпечують процес самообмеження виразки та її загоєння як безпосередньо, так і шляхом стимуляції імунної системи. При цьому антитіла проти НР, що синтезуються в підслизовій оболонці шлунка та дванадцятипалої кишки, ефективно зв'язуються з бактеріальними клітинами та нейтралізують токсини НР та сприяють їх загибелі. Все вищевикладене сприяє створенню рівноваги між так званими факторами агресії та факторами захисту та загоєння пептичного дефекту у гастродуоденальній зоні. Класифікація. Класифікація (Панфілов Ю. А., Осадчук М. А., 1991) Локалізація пептичного дефекту: 1) виразка шлунка (субкардіального та кардіального відділів, пілоричної частини та пілоричного каналу, малої та великої кривизни); 2) виразка дванадцятипалої кишки (цибулини та постбульбарного відділу); 3) виразки шлунка та дванадцятипалої кишки. Течія виразкової хвороби. 1. Легке. Загострення виразки не більше 1 разу на 1-3 роки, загоєння пептичного дефекту закінчується до 5-6-го тижня від початку терапії, вираженість больового та диспепсичного синдромів помірна. 2. Середній тяжкості. Рецидивування не менше 2 разів на рік, епітелізація виразки – протягом 7-12 тижнів, вираженість больового та диспепсичного синдромів. 3. Важке. Періоди ремісії не перевищують 3-4 місяці. Крім вираженого больового синдрому, є ускладнення. Фази захворювання: 1) загострення рецидиву виразки чи функціональні порушення гастродуоденальної системи; 2) ремісія повна (у клінічному, рентгенологічному, ендоскопічному та функціональному аспектах); 3) неповна (зі збереженням функціональних чи структурних порушень у гастродуоденальній зоні). Стан слизової оболонки шлунка та дванадцятипалої кишки: 1) хронічний гастрит; 2) хронічний дуоденіт. Функціональний стан гастродуоденальної системи Секреція: нормальна, підвищена, знижена. Моторика: нормальна, прискорена, сповільнена; евакуація: нормальна, прискорена, уповільнена, дуоденостаз. Ускладнення: кровотеча, перфорація, пенетрація, перигастрит, перидуоденіт, рубцева деформація шлунка та дванадцятипалої кишки. клінічна картина. Клінічна картина виразкової хвороби поліморфна. Симптоматика залежить від статі та віку хворого, пори року, локалізації та величини виразкового дефекту, особистісних та соціальних особливостей пацієнта, його професійних якостей. Клініка визначається сукупністю ознак: хронічним перебігом хвороби з моменту її появи, наявністю ознак загострення та ремісії захворювання, загоєнням дефекту слизової оболонки шлунка та дванадцятипалої кишки з утворенням рубця. Виразкова хвороба представлена двома клініко-морфологічними варіантами: виразкою шлунка та виразкою дванадцятипалої кишки. Традиційно розрізняють больовий та диспептичний синдроми. Провідною клінічною ознакою є біль у верхній половині живота. За характером больового синдрому практично неможливо розмежувати хронічний бактеріальний гастрит та виразкову хворобу. Біль в епігастральній ділянці, натщесерце, переважно навесні та восени однаково часто зустрічається як при виразковій хворобі, так і при хронічному бактеріальному гастриті. Купірування больового синдрому харчовими та лікарськими антацидами досягається і при хронічному бактеріальному гастриті, і при виразковій хворобі. Відмінним для виразкової хвороби дванадцятипалої кишки є лише наявність болю в епігастральній ділянці ночами. Блювота при виразковій хворобі буває рідко. Нудота значно частіше зустрічається при виразці шлунка та при дуоденальній виразці. Запори супроводжують хронічну виразку дванадцятипалої кишки. Симптоматика виразкової хвороби визначається кількістю виразкових дефектів та їх локалізацією. Множинні виразки шлунка в 3 рази частіше зустрічаються у чоловіків. Клінічна картина у разі залежить від локалізації пептичних дефектів. При виразках у тілі шлунка відзначаються тупий біль в епігастрії без іррадіації, що виникає через 20-30 хв після їжі, та нудота. При виразках субкардіального відділу характерні тупі болі під мечоподібним відростком, що іррадіюють у ліву половину грудної клітки. Поєднані виразки шлунка і дуоденальні виразки - це комбінація активної виразки шлунка і виразки дванадцятипалої кишки, що зарубцювалася. Їх характерні тривале збереження больового синдрому, завзятий перебіг хвороби, часті рецидиви захворювання, повільне рубцювання виразки та часті ускладнення. До позацибулинних відносяться виразки, розташовані в області бульбодуоденального сфінктера і дистальніше за нього. Їхня клінічна картина має свої особливості і має багато спільного з дуоденальною виразкою. Вони зустрічаються переважно у хворих віком 40-60 років. Постбульбарні виразки протікають важко і схильні до частих загострень, що супроводжуються масивними кровотечами. Біль, що локалізується у правому верхньому квадранті живота, що іррадіює у спину або під праву лопатку, зустрічається у 100% випадків. Інтенсивність, гострота болю, що стихають лише після прийому наркотичних анальгетиків, доводить хворих до вираженої неврастенії. Сезонність загострень при позацибулинних виразках реєструється майже у 90% хворих. У багатьох хворих кардинальним симптомом стає шлунково-кишкова кровотеча. Для виразок пілоричного каналу характерний симптомокомплекс, названий пілоричним синдромом: біль в епігастрії, нудота, блювання та значне схуднення. Загострення захворювання у своїй дуже тривале. З огляду на інтенсивної противиразкової терапії виразка рубцюється протягом 3 місяців. Рясне кровопостачання пілоричного каналу спричиняє виникнення масивної шлункової кровотечі. Діагностика. При неускладненому перебігу виразкової хвороби у загальному аналізі крові зміни відсутні, можливе деяке зниження ШОЕ, незначний еритроцитоз. При приєднанні ускладнень в аналізах крові з'являються анемія, лейкоцитоз – при залученні до патологічного процесу очеревини. У загальному аналізі сечі змін немає. У біохімічному аналізі крові у випадках ускладненого перебігу виразкової хвороби можливі зміни показників сіалової проби, С-реактивного протеїну, ДФА-реакції. Традиційний метод дослідження при патології шлунка – визначення кислотності шлункового вмісту. Можливі різні показники: підвищені та нормальні, у ряді випадків – навіть знижені. Виразка дванадцятипалої кишки протікає із високою кислотністю шлункового соку. При рентгенологічному дослідженні виразкова хвороба являє собою "нішу" - депо барієвої суспензії. Крім такого прямого рентгенологічного симптому, в діагностиці мають значення непрямі ознаки пептичного дефекту: гіперсекреція вмісту шлунка натщесерце, порушення евакуації, дуоденальний рефлюкс, дисфункція кардії, локальні спазми, конвергенція складок слизової оболонки, рубцева деформація. Гастродуоденоскопія з біопсією є найнадійнішим методом діагностики виразкової хвороби. Вона дозволяє оцінити характер змін слизової оболонки в краї виразки, у периульцерозній зоні та гарантує точність діагнозу на морфологічному рівні. При ендоскопічному та морфологічному дослідженнях встановлено, що більшість виразок шлунка розташовується в області малої кривизни та антрального відділу, набагато рідше – на великій кривизні та в зоні пілоричного каналу. 90% дуоденальних виразок знаходиться у бульбарному відділі. Для виразки виразка типова кругла або овальна форма. Її дно складається із некротичних мас, під якими знаходиться грануляційна тканина. Наявність темних вкраплень на дні свідчить про перенесену кровотечу. Фаза загоєння виразки характеризується зменшенням гіперемії слизової оболонки та запального валу у периульцерозній зоні. Дефект стає менш глибоким, поступово очищається від фібринозного нальоту. Рубець має вигляд гіперемованої ділянки слизової оболонки з лінійними чи зірчастими втягуваннями стінки. Надалі при ендоскопічному дослідженні дома колишньої виразки визначаються різні порушення рельєфу слизової оболонки: деформації, рубці, звуження. При ендоскопії зрілий рубець внаслідок заміщення дефекту грануляційною тканиною має білуватий вигляд, ознаки активного запалення відсутні. При морфологічному дослідженні біоптату, отриманого з дна і країв виразки, виявляється клітинний детріт у вигляді скупчення слизу з домішкою лейкоцитів, що розпадаються, еритроцитів і злущених клітин епітелію з розташованими під ними колагеновими волокнами. Диференціальна діагностика. З повсюдним поширенням ендоскопії особливого значення набуває диференціальна діагностика виразок шлунка та дванадцятипалої кишки (симптоматичні виразки, специфічні виразки при туберкульозі, сифілісі, хвороби Крона, первинно-виразковий рак, вторинні злоякісні). Для симптоматичних виразок має бути причина, що їх викликала (екстремальні впливи, клініко-морфологічні ознаки ендокринних захворювань, серцево-судинних та дихальних розладів, ревматичних хвороб). Більше, ніж для виразкової хвороби, їм характерні множинність поразки, переважна локалізація у шлунку, значні розміри. При виразковій хворобі переважає больовий синдром, а при хронічному гастриті – диспепсичні явища. При хронічних гастритах біль виражений слабко або відсутній, немає сезонності захворювання та обмеженої хворобливості при пальпації; Загострення захворювання часто залежить від характеру їжі. Стан секреторної функції шлунка при гастриті може бути різним. Вирішальне значення мають гастроскопія та гастробіопсія, при яких виявляють зміни слизової оболонки, характерні для гастриту, та виразку при виразковій хворобі. Грижі стравохідного отвору діафрагми (ГПОД) також часто супроводжуються болями в епігастрії. Однак, на відміну від виразкової хвороби, для цього захворювання типові переважно літній вік пацієнтів, зв'язок больового синдрому з положенням тіла (болі посилюються в лежачому положенні, слабшають у вертикальному положенні). Діагноз ДПОД підтверджується результатами рентгенологічного дослідження. Для хронічного холециститу характерні болі в правому підребер'ї та епігастрії, що часто іррадіюють у праву лопатку, у плече, у кут нижньої щелепи праворуч. При безкам'яному холециститі вони мають тупий, монотонний, що давить характер, а при калькульозному набувають характеру коліки. Зазначаються нудота, запори, метеоризм. Можливий стійкий субфебрилітет. При тривалій обтурації жовчних проток може приєднатися жовтяниця. Діагноз ураження біліарної системи верифікується даними УЗД черевної порожнини, рентгенологічного дослідження (холецистографія), ендоскопічної ретроградної холепанкреатографії (ЕРХПГ), а також результатами дуоденального зондування, яке показано лише при безкам'яному процесі. При гострому панкреатиті та загостренні хронічного болю локалізуються у лівій половині епігастральної області, носять оперізуючий характер, провокуються прийомом будь-якої їжі. В анамнезі – патологія біліарної системи, зловживання алкоголем, тривалий прийом панкреотоксичних медикаментів. Об'єктивно виявляють схуднення, поліфекалію, стеаторею, креаторею. Діагноз підтверджується результатами біохімічного дослідження крові на ферменти підшлункової залози, калу – на перетравлюваність, а також інструментальними даними. Лікування. Раціональна терапія виразки повинна включати режим, відповідне харчування, медикаментозне лікування, психотерапію, фізичні та санаторно-курортні методи лікування. У період загострення виразкової хвороби необхідно суворо дотримуватись дробності в харчуванні (від 4 до 6 разів на добу з малим обсягом кожної порції їжі, що приймається у певний годинник). Харчові продукти повинні мати хороші буферні властивості і містити достатню кількість білка (120-140 г). Психотерапія має істотне значення для усунення або зменшення психоневротичних реакцій, що виникають внаслідок наполегливого больового синдрому та його очікування. Медикаменти, що застосовуються для лікування виразки, діляться на 5 груп: 1) препарати, що впливають на кислотно-пептичний фактор (антациди та Н2-блокатори гістаміну, інші антисекреторні засоби); 2) препарати, що покращують слизовий бар'єр шлунка; 3) препарати, які збільшують синтез ендогенних простагландинів; 4) антибактеріальні та антисептичні засоби; 5) препарати, що нормалізують моторно-евакуаторні порушення шлунка та дванадцятипалої кишки. Антациди: 1) розчинні (всмоктуються) – двовуглекисла сода, карбонат кальцію (крейда) та окис магнію (палена магнезія); 2) нерозчинні (невсмоктуються): трисилікат магнію та гідроксид алюмінію. Розчинні антациди мають швидку, енергійну, але короткочасну лужну дію, проте часто викликають побічні ефекти, з чим пов'язана відмова від їх використання в терапії виразкової хвороби. Нерозчинні антациди на основі гідроксиду алюмінію та гідроксиду магнію (альмагель, фосфалюгель, гелюсиллак, топаал, маалокс та ін.) забезпечують тривалу нейтралізацію соляної кислоти, обволікають слизову, оберігаючи її від ушкоджуючої дії кислоти та їжі. Крім нейтралізації соляної кислоти, вони сприяють зменшенню протеолітичної активності шлункового соку, пов'язують лізолецитин і жовчні кислоти, мають універсальну цитопротективну дію. Антациди слід приймати через 1-2 години після їди і на ніч. Маалокс призначається в суспензії (по 15 мл 4 десь у день) чи таблетках (по 1-2 таблетці 4 десь у добу), фосфалюгель - як гелю (по 16 р 3-4 десь у день). Однією з основних побічних дій невсмоктуються антацидів є порушення випорожнень. Препарати з гідроокисом алюмінію викликають запор, а речовини з гідроокисом магнію (маалокс) мають дозозалежний послаблюючий ефект. Нова ера у лікуванні виразкової хвороби почалася з появою Н2-гістамінових блокаторів У фізіологічних умовах гістамін служить посередником екстрагастральних нервових та гуморальних стимулів, що викликають кислотну продукцію. Стимуляція вироблення соляної кислоти гістаміном обумовлена підвищенням активності цАМФ, який впливає на фермент аденілциклазу, що міститься в кислотопродукуючій ділянці шлунка, що посилює секрецію водневих іонів. Отримані дані стали базою для синтезу медикаментів, що переривають участь гістаміну в секреторному процесі на клітинному рівні, таких як циметидин, ранітидин, фамотидин, нізатидин та ін. Крім того, антагоністи Н2-рецепторів гістаміну запобігають порушенням мікроциркуляції в слизовій оболонці шлунка і таким чином попереджають розвиток виразок. Крім цього, вони зменшують вироблення пепсину, підвищують секрецію бікарбонатів, нормалізують гастродуоденальну моторику, збільшують кількість ДНК-синтезуючих клітин епітелію, стимулюючи репаративні процеси та прискорюючи загоєння хронічних виразок шлунка та дванадцятипалої кишки. Однак препарати 1-го покоління (циметидин, цинамет, біломет, тагамет) можуть спричинити зміни з боку нервової системи, явища токсичного гепатиту, порушення ритму та провідності серцево-судинної системи, зміни з боку органів кровотворення. Блокатори Н2-рецепторів гістаміну наступних поколінь – ранітидин (зантак, ранісан, гістак), фамотидин (квамател, лецедил, гастросидин), нізатидин (роксатидин) відрізняються від циметидину гарною переносимістю. Ранітідин призначають у дозі 150 мг 2 рази на добу, фамотидин – 20 мг 2 рази на добу протягом 4-6 тижнів. Для запобігання синдрому відміни після загоєння виразки рекомендується продовжити прийом ранитидину (150 мг) або фамотидину (20 мг) на ніч протягом 2-3 місяців. В останні роки з'явився новий антисекреторний препарат омепразол (оменрол, омез, лосек), який відноситься до похідних бензімідазолу. Він блокує фермент Н+-К+-АТФазу протонного насоса парієтальної клітини. Короткий період напіврозпаду (близько 1 год) та значна тривалість дії (18-24 год) уможливлюють одноразовий прийом даного лікарського засобу. Омепразол призначають по 20 мг на ніч 1 раз на день протягом 2-3 тижнів. Омепразол займає перше місце за вираженістю антисекреторного ефекту серед сучасних противиразкових препаратів. Побічні дії препарату виражені мало. Широке застосування в терапії виразки виявив гастроцепін (нірензепін, гастрозепін), який відноситься до антихолінергічних засобів. Препарат селективно блокує мускаринові рецептори ацетилхоліну, що знаходяться в клітинах слизової оболонки шлунка, що виробляють соляну кислоту та пепсин. Гастроцепін має переважну дію на базальну і стимульовану шлункову секрецію, пригнічує вироблення пепсину, сповільнює евакуацію зі шлунка, викликає гальмування продукції гастрину, знижує рівень панкреатичного поліпептиду, чинить цитопротективну дію шляхом підвищення вироблення глікопротеїнової сполучної кровотечі. . Призначають його по 50 мг 2 десь у день 30 хв до їжі. Курс лікування – у середньому 4 тижні. До лікарських засобів, що зміцнюють слизовий бар'єр шлунка, відносяться препарати колоїдного вісмуту (денол), який формує захисну плівку на слизовій оболонці, знижує пептичну активність шлунка, утворюючи нерозчинну сполуку з пепсином, посилює слизоутворення, надає цитопротективну дію. Денол має здатність пригнічувати життєдіяльність НР у слизовій оболонці шлунка. Препарат призначають по 2 таблетки (240 мг) 2 рази на день за півгодини до їди або через 2 години після їди. Щоб уникнути кумуляції солей вісмуту в організмі, не рекомендується проводити терапію цими препаратами більше 8 тижнів. З метою проведення антибактеріальної терапії при виразці шлунка та дванадцятипалої кишки використовуються тетрациклін, амоксицилін, кларитроміцин. Вони використовуються у комбінації з іншими противиразковими препаратами. Запропоновано декілька схем комбінованої терапії (двох-, три-, чотирикомпонентна). Двокомпонентна терапія: амоксицилін по 1000 мг 2 рази на день протягом 2 тижнів; омепразол по 40 мг двічі на добу. Трикомпонентна схема містить препарат колоїдного вісмуту по 2 мг 120 рази на добу; тетрациклін по 4 мг 250 рази на день; метронідазол по 4 мг 250 рази на день. Цикл терапії – 4 днів. Чотирикомпонентна схема передбачає омепразол по 20 мг 2 рази на добу з 1-го по 10-й день; де-нол по 120 мг 4 рази на добу з 4-го до 10-го дня; тетрациклін по 500 мг 4 рази на добу з 4-го до 10-го дня; метронідазол по 500 мг 3 рази на добу з 4-го до 10-го дня. Найбільш ефективною визнана чотирикомпонентна схема терапії виразкової хвороби шлунка та дванадцятипалої кишки. Через 6 тижнів після її проведення загоєння пептичного дефекту відзначається у 93-96% хворих. Після рубцювання виразки шлунка і дванадцятипалої кишки традиційно використовуються два види лікування. 1) Безперервна підтримуюча терапія проводиться антисекреторними препаратами у половинній добовій дозі на період до одного року. 2) Терапія "на вимогу" передбачає використання одного з антисекреторних засобів у половинній добовій дозі протягом двох тижнів при появі симптомів виразкової хвороби. Прогноз і профілактика. Неускладнені форми захворювання мають сприятливий прогноз для життя та трудової діяльності. При ускладненнях виразкової хвороби прогноз визначається своєчасністю надання хірургічної допомоги. Профілактика рецидивів виразкової хвороби включає динамічне спостереження з обов'язковими контрольними оглядами лікарем 2 рази на рік. Огляди повинні включати клініко-ендоскопічне, а за необхідності морфологічне обстеження. Як профілактика рекомендуються нормалізація режиму сну та відпочинку, відмова від шкідливих звичок, обмеження прийому ульцерогенних медикаментів, раціональне п'ятиразове харчування та використання дво- або трикомпонентної терапії протягом тижня кожні 3 місяці. ЛЕКЦІЯ № 12. Захворювання травного тракту. Хвороби кишечника. Хвороби тонкої кишки. Хронічний ентерит Хронічний ентерит - захворювання тонкої кишки, що характеризується порушенням її функцій (перетравлення та всмоктування) на тлі дистрофічних та дисрегенераторних змін, що завершуються розвитком запалення, атрофії та склерозу слизової оболонки тонкої кишки. Етіологія і патогенез. Це поліетиологічне захворювання, яке може бути результатом гострого запалення тонкої кишки або первинним хронічним процесом. В останні роки велике значення як етіологічний фактор хронічного ентериту надається ієрсиніям, хелікобактеріям, протею, синьогнійній паличці, ротавірусам, численним представникам найпростіших і гельмінтів (лямбліям, аскаридам, лентецям, опісторхіям, криптоспорідіям). Велике значення у виникненні хронічного ентериту відіграють аліментарні фактори – переїдання, їжа всухом'ятку, незбалансована, переважно вуглеводна їжа, зловживання прянощами. До виникнення ентериту призводять іонізуюче випромінювання, вплив токсичних речовин, лікарських препаратів. Серед загальних патогенетичних механізмів хронізації захворювань тонкої кишки виділяють зміни мікрофлори кишківника на тлі зниження місцевого та загального імунітету. Зміни імунного статусу - зниження вмісту секреторного IgА, підвищення рівня IgЕ, зниження бласттрансформації лімфоцитів та пригнічення міграції лейкоцитів - призводять до колонізації тонкої кишки представниками умовно-патогенної мікрофлори та зниження показників нормальної анаеробної флори. Бактеріальне заселення тонкої кишки посилює кишкову секрецію за рахунок активації цАМФ епітеліоцитів, що підвищує кишкову проникність, посилює продукцію клітинами електролітів та води. Секреція води та електролітів призводить до порушення водно-сольового обміну. Під впливом мікробної флори відбувається порушення ентерогепатичної циркуляції жовчі. Жирні кислоти пов'язують іони кальцію, утворюючи малорозчинні мила, що виділяються з фекаліями. Порушенню кальцієвого обміну сприяють зміни метаболізму вітаміну D, що зменшує абсорбцію кальцію. Під впливом порушень обміну жиророзчинних вітамінів знижується вміст мікроелементів у крові. Тривалий дисбіоз сприяє сенсибілізації до мікробних та харчових антигенів, викликає імунне запалення слизової оболонки, що в результаті призводить до утворення тканинних антигенів. Підвищена проникність слизового бар'єру супроводжується резорбцією нерозщеплених білкових макромолекул, що стають алергенами, порушується імунологічна реактивність. При алергії виділяються біологічно активні речовини, що підвищують проникність кишкової стінки, змінюють функціональні властивості ентероцитів. Порушення мікроструктури цитоплазматичної мембрани ентероциту призводять до пригнічення спочатку лактазної, а потім мальтазної та сахаразної активності. При дистрофічних, дисрегенераторних змінах епітеліоцитів знижуються синтез ферментів та їх сорбція на мембранах епітеліоцитів – дисахаридаз, пептидаз, ентерокінази, лужної фосфатази, що спричиняє порушення як мембранного, так і порожнинного травлення. Усе це стає основою синдрому мальабсорбції. На ранніх стадіях хвороби розвиваються розлади ліпідного обміну, зумовлені зменшенням всмоктування жиру, втратою його з фекаліями, змінами кишкової фази ентерогепатичної циркуляції жовчі. Порушення обміну жовчі у свою чергу призводить до порушення обміну ліпідів, що позначається на структурі та функції клітинних мембран. Через недостатнє всмоктування жиру відбувається порушення синтезу стероїдів, що індукує порушення функцій ендокринних залоз. Морфологічно хронічний ентерит проявляється запальними та дисрегенераторними змінами слизової оболонки тонкої кишки. Якщо процес прогресує, спостерігаються її атрофія та склероз. Класифікація (Златкіна А. Р., Фролькіс А. В., 1985). 1) Етіологія: кишкові інфекції, глистяні інвазії, аліментарні, фізичні та хімічні фактори, хвороби шлунка, підшлункової залози, жовчних шляхів. 2) Фази захворювання: загострення; ремісія. 3) Ступінь тяжкості: легка; середньоважка; важка. 4) Течія: монотонна; рецидивне; безперервно рецидивуючий; латентне. 5) Характер морфологічних змін: еюніт без атрофії; еюніт з помірною парціальною атрофією ворсин; еюніт з парціальною атрофією ворсин; еюніт з тотальною атрофією ворсин. 6) Характер функціональних порушень: порушення мембранного травлення (дисахаридазна недостатність), порушення всмоктування води, електролітів, мікроелементів, вітамінів, білків, жирів, вуглеводів. 7) Ускладнення: солярит, неспецифічний мезаденіт. клінічна картина. Клінічна картина хронічного ентериту складається з місцевого та загального ентерального синдромів. Перший обумовлений порушенням процесів пристінкового (мембранного) та порожнинного травлення (мальдігестія). Хворі скаржаться на метеоризм, біль у параумбілікальній зоні, здуття живота у формі ковпака, гучне бурчання, проноси, рідше – запори. При пальпації виявляються болючість у мезогастрії, а також ліворуч і вище пупка (позитивний симптом Поргеса), шум плескоту в ділянці сліпої кишки (симптом Образцова). Кал набуває глинистого вигляду, характерна поліфекалію. Загальний ентеральний синдром пов'язаний із порушенням всмоктування харчових інгредієнтів (мальабсорбція), унаслідок чого виникають розлади всіх видів обміну речовин, змінюється гомеостаз. Характерні багатогранні порушення метаболізму, насамперед білкового, що проявляється прогресуючою втратою маси тіла. Зміни вуглеводного обміну виражені менш значно, що проявляється здуттям, бурчанням у животі та посиленням проносів на фоні прийому молочних продуктів. Значною мірою дефіцит маси тіла у хворих зумовлений не лише білковим, а й ліпідним дисбалансом. Зі змінами ліпідного обміну тісно пов'язані порушення обміну жиророзчинних вітамінів та мінеральних речовин (кальцію, магнію, фосфору). Характерними ознаками кальцієвої недостатності є позитивний симптом м'язового валика, судоми, що періодично виникають "немотивовані" переломи кісток, остеопороз, остеомаляція. Відзначаються також набряклість обличчя, ціаноз губ, глосит, підвищена збудливість, поганий сон. Порушення водно-електролітного балансу проявляються загальною слабкістю, гіподинамією, м'язовою гіпотонією, нудотою, блюванням, змінами ЦНС. Типовими для хронічного ентериту середнього та тяжкого ступеня тяжкості стають симптоми полігіповітамінозу. Гіповітаміноз С клінічно проявляється кровоточивістю ясен, повторними носовими, матковими кровотечами, синцями на шкірі. Гіповітаміноз супроводжується блідістю шкіри, глоситом, ангулярним стоматітом (хейлез). Ознаки дефіциту жиророзчинних вітамінів (А, О, Е, К): поганий сутінковий зір, сухість шкіри та слизових оболонок, підвищена кровоточивість ясен. Тяжкі форми хронічного ентериту протікають із симптомами ендокринної дисфункції (плюригландулярної недостатності). Гіпокортицизм проявляється артеріальною гіпотонією, порушеннями серцевого ритму, анорексією, пігментацією шкіри. Зниження активності статевих залоз супроводжується дисфункцією яєчників, розладами менструального циклу, у чоловіків – імпотенцією, гінекомастією, порушенням оволосіння. Дисфункція щитовидної залози характеризується загальною слабкістю, сухістю шкіри, брадикардією, зниженням працездатності, інтелектуально-мнестичними розладами. Діагностика та диференціальний діагноз. У загальному аналізі крові виявляють мікро- та макроцитарну анемію, збільшення ШОЕ, у важких випадках – лімфо- та еозинопенію. При паразитарному походженні захворювання в крові можуть спостерігатися лімфоцитоз, еозинофілія. При копрологічному дослідженні виявляють кишковий тип стеатореї за рахунок жирних кислот та мил, креаторею, амілорею. Збільшується вміст ентерокінази та лужної фосфатази в калі. Добова маса фекалій значно зростає. При бактеріологічному аналізі калу виявляють дисбактеріоз різного ступеня. Відзначається зменшення лакто- та біфідобактерій, ентерококів, з'являються штами кишкової палички із зміненими ферментативними властивостями. У загальному аналізі сечі при тяжкій формі хронічного ентериту відзначаються мікроальбумінурія та мігрогематурія. У біохімічному аналізі крові виявляють гіпопротеїнемію, гіпоальбумінемію, гіпоглобулінемію, гіпокальціємію, зниження рівня магнію, фосфору, інших мікроелементів, порушення електролітного обміну у вигляді зниження рівня натрію та калію. Порушення ліпідного обміну супроводжуються змінами ліпідного спектру: знижується рівень холестерину, фосфоліпідів, а також змінюється спектр жовчних кислот, фосфоліпідів та тригліцеридів. Результати рентгенологічного дослідження дозволяють уточнити моторну функцію тонкої кишки та рельєф слизової оболонки, дистонічні та дискінетичні зміни у вигляді уповільнення або прискорення пасажу суспензії сульфату барію по тонкій кишці, а рельєф слизової оболонки змінюється у вигляді нерівномірного потовщення, деформації. Гастродуоденоскопія виявляє атрофічний гастрит та дуоденіт. Морфологічна картина легкої форми хронічного ентериту характеризується потовщенням ворсинок, їх деформацією, зменшенням глибини виїмок, зниженням тонусу гладких м'язів, подепітеліальним набряком, дистрофічними змінами поверхні епітелію, витонченням щіткової облямівки клітин, зменшенням числа келихоподібних клітин в області ворсинок, збільшенням слизової лімфоплазмоцитарними елементами, зменшенням клітин Панета в ділянці дна крипт. Для середньоважкої форми типовими є парціальна атрофія ворсинок, зменшення числа крипт, стоншення слизової оболонки, зменшення щіткової облямівки, лімфоплазмоцитарна інфільтрація підслизового та м'язового шарів. Тяжка форма захворювання характеризується прогресуючою атрофією ворсинок, що діагностується за гістологічними, гістохімічними та морфометричними критеріями. Процес проліферації ентероцитів переважає їх диференціюванням, утворюється велика кількість незрілих, неповноцінних клітин. Диференціальна діагностика при хронічному ентериті проводиться з глютеновою ентеропатією, хворобою Крона, хворобою Віппла, амілоїдозом кишечника, дивертикулярною хворобою, лімфомою, пухлинами тонкої кишки. Спільними всім перелічених станів є клінічні синдроми порушення травлення, всмоктування і дисбактеріоз. Остаточно діагноз підтверджується при морфологічному дослідженні слизової оболонки тонкої кишки. Так, для глютенової ентеропатії типово анамнестична вказівка про зв'язок загострень захворювання з вживанням гліадинсодержащих продуктів. Клініка глютенової ентеропатії нагадує хронічний ентерит. Найчастіше уражаються верхні відділи кишечника і відсутні зміни у здухвинній кишці. Оптимальним ділянкою взяття біоптатів стає область слизової оболонки поблизу зв'язки Трейтца. При морфологічному дослідженні виявляють зменшення кількості келихоподібних клітин та збільшення числа міжепітеліальних лімфоцитів, субтотальну атрофію ворсинок, запальну інфільтрацію клітинного власного шару. При глютенової ентеропатії морфологічні зміни і натомість аглютенової дієти носять оборотний характер, на відміну банального хронічного ентериту, у якому морфологічні зміни незворотні. При хворобі Крона відзначається клінічний поліморфізм, зумовлений аутоімунним генезом захворювання та властивими йому системними проявами (такими як аутоімунний тиреодит, поліартрит, ірит, гепатит, часте поєднання ентериту та дистального коліту). Великою роздільною здатністю у верифікації хвороби Крона мають ендоскопічні та морфологічні тести, що виявляють мозаїчний характер ураження кишечника, типові зміни на кшталт "бруківки", які чергуються з ділянками непошкодженої слизової оболонки. При рентгенологічному, ендоскопічному обстеженні можна виявити стриктуру кишечника, іноді утворюються кишкові нориці. Морфологічна діагностика констатує запально-клітинну інфільтрацію всіх шарів кишкової стінки з максимумом ураження підслизового шару та мінімальними змінами слизової оболонки. У підслизовому шарі виявляються патогномонічні для цього захворювання лімфоцитарні саркоїдоподібні гранульоми. Для хвороби Уіппла, крім ознак ентериту, характерні позакишкові прояви у вигляді лихоманки, артриту, лімфаденопатії, артеріальної гіпотонії, пігментації шкіри. Найбільш інформативними є морфологічні критерії захворювання. У біоптатах, взятих з тонкої кишки, виявляють внутрішньоцелюлярне та екстрацелюлярне накопичення жиру в слизовій оболонці тонкої кишки та в мезентеріальних лімфатичних вузлах; інфільтрацію власного шару великими мікрофагами, що містять ШІК-позитивні гранули, вільні від жиру, та наявність у слизовій оболонці бацил. Лікування. Лікування хронічного ентериту має бути комплексним, що включає засоби, що впливають на етіологічні фактори, патогенетичні механізми, а також на місцеві і загальні симптоми захворювання. Базовим є дієтичне харчування, яке сприяє зниженню підвищеного осмотичного тиску в порожнині кишечника, знижує секрецію, нормалізує пасаж кишкового вмісту. Виключають продукти, що містять грубу рослинну клітковину (сирі овочі, фрукти, житній хліб, горіхи, здобне тісто, консерви, прянощі, гострі страви, незбиране молоко, пиво, квас, газовані та спиртні напої). Обмежується вживання кухонної солі. Необхідний дрібний прийом їжі, до 5-6 разів на день. У період ремісії до раціону вводяться деякі овочі та фрукти, до 100-200 г на день. Призначають листя салату, зрілі помідори без шкірки, м'які груші, солодкі яблука, апельсини, мандарини, малину, полуницю, суницю. Їжа має бути вареною або приготовленою на пару. Лікарська терапія має бути етіотропною, патогенетичною та симптоматичною. Етіотропне лікування: при дисбіозі II-IV ступеня призначають препарати антибактеріальної дії: метронідазол (по 0,5 г 3 рази на добу), кліндаміцин (по 0,5 г 4 рази на добу), цефалексин (по 0,5 г 2 рази на добу) добу), бісептол (по 0,48 г 2 рази на добу), сульгін (по 1 г 3-4 рази на добу), фуразолідон (0,1 г 4 рази на добу). Після застосування антибактеріальних препаратів призначають еубіотики - біфідумбактерин або біфікол по 5 доз 3 рази на добу за 30 хв до їди, коли-бактерин або лактобактерин по 3 дози 3 рази на добу до їди, хілакфорті по 40 крапель 3 рази на день перед їдою. Лікування бактерійними препаратами проводять тривало: 3 курси по 3 місяці протягом року. При стафілококовому дисбактеріозі призначають антистафілококовий бактеріофаг (по 20 мл 3 рази на день протягом 15-20 днів), при протейному дисбактеріозі - коліпротейний бактеріофаг внутрішньо по 20 мл 3 рази на добу, курс лікування - 2-3 тижні. Як антидіарейні симптоматичні засоби призначають імодіум (лоперамід) по 1 капсулі 2-3 рази на добу до їди на 3-5 днів. Для покращення процесу травлення рекомендуються ферментні засоби: панкреатин, панзинорм форте, фестал, дигестал, панкурмен, мезим форте, трифермент, дози яких підбираються індивідуально (від 1 таблетки 3 рази на добу до 3-4 таблеток 4 рази на день) та які призначають безпосередньо до або під час їди протягом 2-3 місяців. При необхідності замісну терапію ферментами продовжують більш тривалий час. Для нормалізації загального стану хворих з ентеритом та ліквідації обмінних розладів показано замісну терапію. З метою поповнення дефіциту вітамінів на 4-5 тижнів призначають вітаміни В і В6 по 50 мг, РР – 10-30 мг, С – по 500 мг. При стеатореї показано парентеральне введення вітаміну В2 (100-200 мкг) у поєднанні з жиророзчинними вітамінами. Внутрішньо призначають рибофлавін по 0,02 г, фолієву кислоту по 0,003 г рази на день, вітамін Е по 3300 МО 2 рази на день. При хронічному ентериті, що протікає з вираженою білковою недостатністю, поряд з дієтою показано парентеральне введення плазми по 150-200 мл білкових гідролізатів та сумішей амінокислот (амінопептиду, альвезину, поліаміну, інтрафузин по 250-500 мл гормонами (ретаболілом по 20 мл 2,0 раз на 1-7 днів протягом 10-3 тижнів) та жировими сумішами типу інтраліпіду. Призначення стероїдів показано лише при значній білковій недостатності, при гіпопротеїнемії, наявності надниркової недостатності. Для корекції водно-електролітних порушень показані внутрішньовенні введення панангіна 20-30 мл, глюконату кальцію 10%-ного 10-20 мл у 200-400 мл ізотонічного розчину або розчину глюкози, полііонні розчини "Дісоль", "Трисоль", "Кварта". Електролітні розчини вводять внутрішньовенно протягом 10-20 днів під контролем кислотно-основного стану та рівня електролітів крові. Прогноз і профілактика. Прогноз для життя та працездатності здебільшого сприятливий. Прогностично несприятливими ознаками є безперервно-рецидивний перебіг хвороби, різке схуднення, анемія, синдром ендокринних порушень (зниження лібідо, дисменорея, безплідність). Профілактика хронічних ентеритів полягає у своєчасному лікуванні гострих кишкових інфекцій та супутніх захворювань гастродуоденальної зони, у дотриманні режиму харчування, у профілактичному прийомі бактерійних препаратів при проведенні рентгено- та радіотерапії. ЛЕКЦІЯ № 13. Захворювання травного тракту. Хвороби кишечника. Хвороба Крона Хвороба Крона – хронічне захворювання кишечника із системними проявами; морфологічна основа якого становить гранулематозне аутоімунне запалення шлунково-кишкового тракту. Етіологія і патогенез. Етіологія та патогенез захворювання вивчені недостатньо. Найбільш популярними вважаються інфекційна та імунна концепції виникнення хвороби. В останні роки з'явилися повідомлення про етіологічну роль мікроорганізмів роду єрсиній. Однак важко встановити, чи ці мікробні агенти є збудниками або комменсалами. Водночас у патогенезі захворювання важлива роль належить змінам у кишковій мікрофлорі. Типово зменшення бактерій типу біфідум при одночасному збільшенні ентеробактерій, що мають ознаки патогенності. У розвитку захворювання мають значення аутоімунні механізми. При хворобі Крона з'являються аутоантитіла (IgС, IgМ) проти тканин кишківника. Морфологічним субстратом захворювання є аутоімунний запальний процес, який виникає спочатку в підслизовому шарі, поширюється на всю товщу кишкової стінки і характеризується наявністю гранулематозних інфільтратів з наступними виразками слизової оболонки, розвитком абсцесів і свищів, що загоюються з просвітками і завищують. Зі збільшенням тривалості хвороби наростає протяжність ураження та з'являються симптоми позакишкових порушень. Класифікація. Класифікація (Ф. І. Комаров, А. І. Казанов, 1992). 1) Течія: гостра; хронічний. 2) Характеристика процесу: ураження у межах тонкої кишки; поразка в межах ілеоцекальної області; ураження в межах товстої кишки. 3) Ускладнення: звуження кишки; токсична дилатація товстої кишки; нориці; амілоїдоз; нефролітіаз, холелітіаз; У12-Дефіцитна анемія. клінічна картина. Клінічна картина хвороби Крона характеризується значною різноманітністю, яка визначається локалізацією та протяжністю патологічного процесу в кишечнику, формою захворювання та приєднанням ускладнень. Початок хвороби може бути гострим, коли захворювання від початку прогресує, і хронічним, коли хвороба починається поволі. У першому випадку діагноз частіше встановлюють при лапаротомії, що проводиться з приводу передбачуваного апендициту, або кишкової непрохідності, що розвинулася без видимих причин в молодого віку. При цьому виявляють гіперемовану ділянку тонкої кишки, збільшені лімфовузли кореня брижі, характерні для хвороби Крона. Хворі пред'являють скарги на біль у животі без певної локалізації, послаблення випорожнень без видимих патологічних домішок, схуднення, субфебрильну температуру тіла. При об'єктивному дослідженні звертають увагу на блідість шкірних покривів, що корелює з вираженістю анемії, набряки на ногах внаслідок порушення всмоктування та обміну білка. При пальпації живота відзначаються метеоризм, бурчання. При локалізації процесу в товстій кишці відзначаються чергування запорів з проносами, переймоподібні болі в животі, рідкий або напівоформлений стілець, що містить домішку крові. При ураженні верхніх відділів шлунково-кишкового тракту виникає симптоматика, що нагадує хронічний езофагіт, хронічний гастрит, хронічний дуоденіт. Можуть відзначатися болі за грудиною при проходженні їжі стравоходом, нічні та "голодні" болі в епігастрії, болючість при пальпації в пилородуоденальній зоні. При фізикальному обстеженні хворого визначаються блідість шкіри, субфебрилітет, дефіцит маси тіла, при пальпації виявляють спазмовані петлі кишечника, болючість у параумбілікальній зоні, у правій здухвинній ділянці. При хворобі Крона відзначаються позакишкові ознаки захворювання: афтозний стоматит, флегмони та нориці ротової порожнини, артрит, що нагадує по клініці ревматоїдний, з характерними симптомами симетричного ураження дрібних суглобів, скутістю вранці. Типові зміни з боку очей: ірит, іридоцикліт, макулопатія. На шкірі можлива поява вузлової еритеми та гангренозної піодермії. Діарея характеризується збільшенням частоти випорожнень до 10 разів на добу і більше, поліфекалією. Обсяг випорожнень визначається анатомічною локалізацією процесу: при ураженні проксимальних відділів тонкої кишки обсяг калових мас значно більший, ніж при ураженні дистальних відділів. Втрата маси тіла спостерігається у всіх хворих. Діагностика та диференціальний діагноз. У клінічному аналізі крові у період загострення виявляють лейкоцитоз, анемію, підвищення ШОЕ. Зміни у загальному аналізі сечі з'являються при тяжкій формі, що характеризується приєднанням амілоїдозу нирок (протеїнурія). При біохімічному дослідженні крові виявляються гіпопротеїнемія, гіпоальбумінемія, збільшення α-глобулінів, зниження вмісту заліза, вітаміну В12, фолієвої кислоти, цинку, магнію та калію. Дані копрологічного дослідження дозволяють опосередковано оцінити рівень поразки. У копрограмі при тонкокишковій локалізації процесу виявляють поліфекалію, стеаторею, креаторею; при товстокишковій – домішка слизу, лейкоцити, еритроцити. Рентгенологічна діагностика дозволяє встановити локалізацію та поширеність патологічного процесу в кишечнику. Ділянки ураженого кишечника чергуються з ділянками незміненої кишки. Змінені петлі стають ригідними, мозаїчна картина з дрібними дефектами наповнення і з проникненням контрасту за межі кишкової стінки у вигляді кишень. Кишка в зоні ураження набуває характеру дрібнобахромчастої, з формуванням псевдодивертикулів. Контрактильна здатність кишкової стінки знижується або повністю втрачається, евакуація барію сповільнюється. Спостерігається нерівномірне звуження просвіту кишки, в результаті він стає настільки вузьким, що набуває вигляду шнурка. Над зоною звуження кишка розширюється. Ендоскопічна діагностика набуває вирішального значення у верифікації діагнозу. Для хвороби Крона найбільш характерна зміна антрального відділу шлунка та початкового відділу дванадцятипалої кишки. Ендоскопічно можливе виявлення циркулярного звуження антрального відділу, що нагадує пухлинний стеноз. Початковий період хвороби Крона характеризується мізерними ендоскопічними даними: тьмяна слизова оболонка, на тлі якої видно ерозії на кшталт афт, оточені білуватими грануляціями. Судинний малюнок відсутній або згладжений. У просвіті кишки та її стінках визначається гноевидная слиз. При клінічній ремісії ці зміни можуть повністю зникати. У міру прогресування захворювання слизова оболонка стає нерівномірно потовщеною, має білуватий колір, відзначаються великі поверхневі або глибокі виразки-тріщини. Просвіт кишки звужується, ускладнюючи поступ колоноскопа. Колоноскопія дає можливість виконати прицільну біопсію слизової оболонки на будь-якій ділянці товстої кишки та в термінальному відділі клубової. При хворобі Крона патологічний процес починається в підслизовому шарі, тому біопсія повинна проводитися так, щоб у біопсійний матеріал потрапила ділянка підслизового шару. У зв'язку з викладеним у 54% випадків морфологічний субстрат хвороби не виявляється. Диференціювати хворобу Крона необхідно від неспецифічного виразкового коліту, гастроінтестинального туберкульозу, ішемічного коліту, хвороби Уіппла, дивертикулярної хвороби, псевдомембранозного коліту, лімфогранулематозу, первинного тонкокишкового амілоїдозу, хрон. Спільним для всіх перелічених захворювань є синдром кишкової диспепсії та деякі системні ураження. Однак для неспецифічного виразкового коліту характерна зміна дистальних ділянок товстої кишки з обов'язковим залученням до процесу прямої та сигмоподібної. При неспецифічному виразковому коліті немає сегментарності ураження; рідше, ніж при хворобі Крона, визначаються системні прояви і менш виражений синдром мальабсорбції. Однак найточніше діагноз хвороби Крона підтверджують дані ендоскопії з прицільною біопсією. Гастроінтестинальну форму туберкульозу відрізняють від хвороби Крона часта локалізація в здухвинній кишці, ендоскопічні дані, що дозволяють виявити виразки з піднятими краями, що відшарувалися, заповнені сіруватим вмістом. Загоюються такі виразки з утворенням короткого рубця, чого не відзначається при хворобі Крона. В осіб похилого віку виникає необхідність диференціювати хворобу Крона та ішемічний коліт. Для останнього типові напади інтенсивного болю в животі після їжі, характерні ирригоскопически виявляються колітичні зміни в селезінковому згині, низхідній і сигмовидної кишці. Найбільш важливою рентгенологічною ознакою ішемічного коліту є симптом "відбитка великого пальця". При ендоскопічному та морфологічному дослідженні в біопсійному матеріалі виявляють типові для ішемічного коліту гемосидеринвмісні клітини та фіброз. Діагноз лімфогранулематозу та первинного кишкового амілоїдозу ставиться на підставі гістологічного дослідження. У першому випадку в біоптаті з брижового лімфовузла виявляють клітини Березовського-Штернберга, у другому - у слизовій оболонці прямої кишки є відкладення амілоїду. Лікування. Призначають механічно і хімічно дієту, що щадить, з підвищеним вмістом білків, вітамінів, мікроелементів, з винятком молока при його непереносимості, обмеженням грубої рослинної клітковини. Показано застосування рідких ентеральних гідролізатів. Основу патогенетичної медикаментозної терапії складають салазопрепарати та кортикостероїди. Добова доза препаратів – 3-6 г. При локалізації патологічного процесу у товстій кишці активність сульфасалазину перевищує активність преднізолону. За відсутності ефекту від застосування сульфасалазину, при ураженні переважно тонкої кишки та виражених ознак імунного запалення, а також за наявності системних проявів захворювання показано застосування кортикостероїдів. Ефект від їх застосування відзначається у перші 8 тижнів від початку лікування. Преднізолон призначають за наступною схемою: у розпал загострення 60 мг на добу, потім дозу поступово знижують і до 6-10-го тижня доводять до підтримуючої – 5-10 мг на добу. При досягненні клінічної ремісії препарат поступово скасовують. Якщо ремісії не досягнуто, лікування преднізолоном триває амбулаторно до 52 тижнів. При тяжкому перебігу захворювання у разі розвитку ускладнень у вигляді торпідно поточних ректовагінальних, шкірно-ентеральних, ентероентеральних свищів показано призначення 6-меркаптопурину всередину по 0,05 г 2-3 рази на день 10-денними курсами з інтервалом у 3 дні до досягнення клінічної . Надалі переходять приймання підтримують доз препарату протягом року. Доза 6-меркаптопурину становить 75 мг на добу. Ефект лікування імунодепресантами можна визначити не раніше ніж через 3-4 місяці. Широке застосування в лікуванні хвороби Крона знайшов метронідазол, основними показаннями до призначення якого є періанальні нориці та тріщини, відсутність ефекту від салазопрепаратів та глюкокортикоїдів, а також рецидиви захворювання після проктектомії. Препарат призначають у дозі 500-1000 мг на добу. Тривалість безперервного курсу має перевищувати 4 тижнів. Симптоматична терапія хвороби Крона зводиться до призначення коротких курсів (по 2-3 дні) антидіарейних препаратів (імодіуму, лопераміду). Дози підбираються індивідуально за клінічним ефектом. Не слід призначати антидіарейні засоби тривалий час (більше 5 днів). У зв'язку з наявністю при хворобі Крона синдрому мальабсорбції використовують ферментні препарати, що не містять жовчних кислот (панкреатин, мезимфорт, солізим, сомілаза) у дозі від 2 до 6 таблеток з кожним прийомом їжі. За показаннями проводиться корекція анемії та гіпоальбумінемії призначенням препаратів заліза (парентерально) та введенням альвезину, гідролізаторів білків, амінопептиду, амінокровину. Призначають полівітаміни у дражі, есенціалі у капсулах. Лікування дисбактеріозу проводять за загальними правилами. Прогноз і профілактика. При хворобі Крона прогноз для життя за своєчасної діагностики та ефективного динамічного спостереження сприятливий, для трудової діяльності - невизначений. У пацієнтів з тяжким перебігом захворювання, за наявності ускладнень та системних проявів, встановлюється І або ІІ група інвалідності. Хвороба Крона відноситься до передракових захворювань. Пацієнта потрібно детально ознайомити з особливостями перебігу захворювання та попередити про можливі ускладнення, описавши в доступній формі їх клінічні прояви. ЛЕКЦІЯ № 14. Захворювання травного тракту. Хвороби товстої кишки. Неспецифічний виразковий коліт Неспецифічний виразковий коліт - запальне захворювання, що вражає слизову оболонку товстої кишки з виразково-деструктивними змінами, що має хронічний рецидивний перебіг, що нерідко супроводжується розвитком небезпечних для життя ускладнень. Етіологія і патогенез. Неспецифічний виразковий коліт – ідіопатичне захворювання. Причини виникнення невідомі. З безлічі теорій, що пояснюють походження хвороби (інфекційна, ферментативна, алергічна, імунна, нейрогенна та ін.), найбільший інтерес викликає інфекційна теорія, проте спроби виділити збудник із вмісту товстої кишки виявилися безуспішними. Патологічний процес при хронічному неспецифічному виразковому коліті починається в прямій кишці і поширюється в проксимальному напрямку, захоплюючи ділянки товстої кишки, що лежать вище. Запалення може обмежитися прямою кишкою (проктит), прямою і сигмовидною (проктосигмоїдит), поширитися на весь лівий відділ (лівосторонній коліт) або вражати всю товсту кишку (тотальний коліт). У функціональному відношенні довжина товстої кишки при неспецифічному коліті зменшується приблизно на 1/3. При дослідженні патологоанатомічного матеріалу виявляється дифузне запалення слизової оболонки товстої кишки (виражений набряк та повнокров'я, потовщення складок). У слизовій оболонці утворюються виразки різних розмірів, що мають неправильну форму, дно яких розташовується в слизовій оболонці, рідше - в підслизовому шарі, в м'язовій та серозній оболонці. Морфологічно у початковому періоді визначається інфільтрат у власній платівці слизової оболонки, що складається з лімфоцитів з домішкою поліморфно-ядерних лейкоцитів, розширення кровоносних судин та набухання ендотелію цих судин. Порушення мікроциркуляції супроводжується розвитком гіпоксії, яка посилює порушення структури та функції епітелію слизової оболонки. Стадія виражених клінічних проявів супроводжується лейкоцитарною інфільтрацією поверхневого шару епітелію, розвитком криптиту, у якому виникають скупчення нейтрофілів у просвіті крипт. Дистальні відділи криптів облітеруються, з'являються крипт-абсцеси, в освіті яких важливу роль відіграє порушення дозрівання епітеліоцитів. При некрозі епітелію, що вистилає крипти, крипт-абсцеси розкриваються, утворюються виразки. У період ремісії слизова оболонка відновлюється, та її атрофія, деформація крипт, нерівномірне потовщення власної платівки зберігаються. Класифікація (Ю. В. Балтайтіс із співавт., 1986). Клінічна характеристика. 1. Клінічна форма: 1) гостра; 2) хронічна. 2. Течія: 1) швидко прогресуюче; 2) безперервно рецидивуючий; 3) рецидивуючий; 4) латентне. 3. Ступінь активності: 1) загострення; 2) загасне загострення; 3) ремісія. 4. Ступінь тяжкості: 1) легка; 2) середньої тяжкості; 3) важка. анатомічна характеристика. 1. Макроскопічна характеристика: 1) проктит: 2) проктосигмоїдит; 3) субтотальне ураження; 4) тотальна поразка. 2. Мікроскопічна характеристика: 1) переважання деструктивно-запальних процесів; 2) зменшення запальних процесів із елементами репарації; 3) наслідки запального процесу Ускладнення. 1. Місцеві: 1) кишкова кровотеча; 2) перфорація товстої кишки; 3) звуження товстої кишки; 4) псевдополіпоз; 5) вторинна кишкова інфекція; 6) зникнення слизової оболонки; 7) токсична дилатація товстої кишки; 8) малігнізація. 2. Загальні: 1) функціональний гіпокортицизм; 2) сепсис; 3) системні прояви – артрити, сакроілеїти, ураження шкіри, ірити, амілоїдоз, флебіти, склерозуючий холангіт, дистрофія печінки. клінічна картина. Клініка виразкового коліту поліморфна і залежить від гостроти перебігу та тяжкості процесу. Перебіг запального процесу, що розглядається частіше як хронічний, у ряді випадків набуває гострого характеру. Протяжність ураження товстої кишки може змінюватися. Для неспецифічного виразкового коліту характерні 3 провідні симптоми: виділення червоної крові при дефекації, порушення функцій кишечника та біль у животі. Виділення крові (від прожилок на поверхні калу до 300 мл і більше) при дефекації – перша ознака захворювання. При гострій формі захворювання кров виділяється струменем, що призводить до зниження артеріального тиску аж до розвитку колапсу та геморагічного шоку. Порушення функцій кишечника проявляється у вигляді скарг на багаторазовий нестійкий стілець, який стає наслідком великого ураження слизової оболонки та зниження всмоктування води та солей. Найчастіше діарея спостерігається при тяжкій формі неспецифічного виразкового коліту. Однак діарея не є надійним критерієм тяжкості процесу. Має значення вираженість діареї у поєднанні з наявністю яскраво-червоної крові в калі. У значної кількості хворих з неспецифічним виразковим колітом кров і слиз періодично виявляються лежить на поверхні оформленого калу, що часто помилково розцінюється як прояв геморою. Пацієнти пред'являють скарги на біль у нижніх відділах живота переймоподібного або постійного характеру, який частіше локалізується в гіпогастрії або лівій здухвинній ділянці, посилюється перед актом дефекації та зникає після нього. Нерідко спостерігаються тенезми. При залученні до процесу підслизового, м'язового та серозного шарів кишечника відбувається посилення болю; при пальпації живота утворюється дефанс м'язів передньої черевної стінки. Легкий перебіг неспецифічного виразкового коліту характеризується задовільним станом пацієнтів. Болі в животі помірні та короткочасні. Стілець оформлений, прискорений, до 2-3 разів на добу. У калі виявляються кров та слиз. Процес локалізований у межах прямої та сигмовидної кишок. Клінічний перебіг рецидивуючий. Ефект лікування салазопрепаратами задовільний. Рецидиви спостерігаються не частіше 2 разів на рік. Ремісії можуть бути тривалими (понад 2-3 роки). Середньотяжкий перебіг захворювання діагностують за наявності у хворого на діарею. Стілець частий (до 6-8 разів на добу), у кожній порції видно домішку крові та слизу. Переймоподібні болі в животі мають більшу інтенсивність. Спостерігаються лихоманка, що інтермітує, з підйомом температури тіла до 38 °C, інтенсивна загальна слабкість. Можуть відзначатись і позакишкові прояви захворювання (артрит, увеїт, вузлова еритема). Перебіг безперервно-рецидивний, ефект від салазопрепаратів нестійкий, у період загострень призначають гормони. Для важкої форми захворювання характерний гострий початок. Швидко розвивається тотальне ураження товстої кишки з поширенням патологічного процесу вглиб кишкової стінки. Стан хворого різко погіршується. Клініка характеризується раптовим початком, високою лихоманкою, профузними проносами до 24 разів на добу, кишковою кровотечею, швидким наростанням зневоднення. З'являється тахікардія, знижується артеріальний тиск, наростають позакишкові прояви неспецифічного виразкового коліту. Консервативне лікування не завжди ефективне, нерідко потрібне екстрене хірургічне втручання. Діагностика та диференціальний діагноз. У клінічних аналізах крові за легкої форми захворювання відзначаються незначний нейтрофільний лейкоцитоз, збільшення ШОЕ, показники червоної крові не змінені. У міру наростання тяжкості перебігу та збільшення тривалості загострення виникають анемії змішаного генезу (В12-дефіцитна та залізодефіцитна), підвищується ШОЕ. У біохімічному аналізі крові при середньотяжкій та тяжкій формах відзначаються диспротеїнемія, гіпоальбумінемія, гіпергаммаглобулінемія, порушення електролітного балансу, кислотно-лужного стану. У загальному аналізі сечі зміни з'являються лише при виникненні ускладнень у вигляді нефротичного синдрому на тлі амілоїдозу, коли відзначаються характерні зміни в аналізах сечі – протеїнурія, "мертвий" сечовий осад, відзначається також підвищення в крові та рівня креатиніну, сечовини. Головну роль у діагностиці набуває ендоскопічне дослідження з прицільною біопсією, оскільки при неспецифічному виразковому коліті уражається насамперед слизова оболонка товстої кишки. У патологічний процес завжди залучається пряма кишка, т. е. ерозивно-виразкові зміни виявляються при ендоскопії відразу ж за анальним сфінктером при ректороманоскопії. При виразковому коліті ректосигмоїдний вигин подолати який завжди можливо через вираженого спазму. Спроба провести тубус ректоскопа супроводжується вираженими болючими відчуттями. У цій ситуації ректоскоп слід вводити на глибину трохи більше 12-15 див. Колоноскопію під час вираженого загострення неспецифічного виразкового коліту проводити небезпечно. До неї слід вдаватися за високого ризику малигнізації. У цьому слід зазначити високу інформативність сигмоскопії. Ендоскопічна картина залежить від форми захворювання. При легкій формі видно набрякла тьмяна слизова оболонка, густі білуваті накладення слизу на стінках кишки, незначна контактна кровоточивість. Судинний малюнок підслизового шару візуально не визначається. При середньотяжкому перебігу захворювання виявляються гіперемія та набряк слизової оболонки, виражена контактна кровоточивість, геморагії, ерозії та виразки неправильної форми, густі накладення слизу на стінках кишки. При тяжкому перебігу захворювання слизова оболонка товстої кишки руйнується значному протязі. Виявляються зерниста, внутрішня поверхня, що кровоточить, великі зони виразок з фібринозними накладаннями, псевдополіпи різної величини і форми, гній і кров у просвіті кишки. Протипоказанням до проведення колоноскопії та сигмоскопії є важкі форми неспецифічного виразкового коліту у гострій стадії хвороби. Рентгенологічне дослідження дозволяє визначити довжину поразки; уточнити діагноз при недостатньо переконливих даних ендоскопії; диференціальну діагностику із хворобою Крона, дивертикулярною хворобою, ішемічним колітом; своєчасно виявити ознаки малігнізації. На оглядових рентгенограмах може бути виявлено укорочення кишки, відсутність гаустрації, токсична дилатація, вільний газ під куполом діафрагми при перфорації. Іригоскопія повинна проводитися з великою обережністю. Вона може спровокувати погіршення стану хворого. У деяких випадках підготовку хворого до іригоскопії за допомогою клізм та проносних доводиться замінювати спеціальною дієтою, що призначається за 2 дні до дослідження. У ряді випадків використання контрастної клізми може прискорити перфорацію або спричинити токсичну дилатацію товстої кишки. Тому іригоскопія проводиться після стихання гострих явищ. При цьому методі виявляються нерівність і "зернистість" слизової оболонки, потовщення кишкової стінки, виразки, псевдополіпоз, відсутність гаустрації. Диференціальна діагностика неспецифічного виразкового коліту проводиться насамперед із гострими кишковими інфекціями. За наявності епідемії кишкових інфекцій діагноз встановлюється легко. Але навіть у разі спорадичної захворюваності при гострих кишкових інфекціях колітичний синдром тече без рецидивів, тоді як неспецифічний виразковий коліт має рецидивний перебіг. До найточніших методів ідентифікації гострої кишкової інфекції відносять бактеріологічний та серологічний. Часто неспецифічний виразковий коліт диференціюють із хворобою Крона. У типових випадках хвороба Крона відрізняється від неспецифічного коліту відсутністю ураження прямої кишки, частим залученням до патологічного процесу клубової кишки, сегментарним ураженням кишкової стінки. Остаточний діагноз може бути поставлений при виявленні в біоптатах специфічних для хвороби лімфоїдних Крона гранульом. При гранулематозному коліті частіше, ніж при неспецифічному виразковому виявляються парапроктити, параректальні свищі. У ряді випадків виникає необхідність розмежування виразкового коліту та інтестинального туберкульозу. Для інтестинального туберкульозу характерні певна локалізація процесу (клубова кишка, ілеоцекальна область), сегментарне ураження кишечника. Але іноді при інтестинальному туберкульозі уражаються пряма та вся товста кишка. Колоноскопічна картина туберкульозу кишечника характеризується наявністю виразок з піднятими краями, заповненими сіруватим вмістом. Туберкульозні виразки мають тенденцію до поширення у поперечному напрямі і залишають по собі короткі рубці, у яких знову виникають виразки. При неспецифічному виразковому коліті дома колишніх виразок рубці не утворюються. В осіб похилого та старечого віку неспецифічний виразковий коліт слід диференціювати з ішемічним колітом. Для останнього характерні інтенсивні, нападоподібні болі в животі через 20-30 хв після їди, тоді як при неспецифічному виразковому коліті болі виникають перед актом дефекації. Найбільш важливою рентгенологічною ознакою є симптом "відбитка великого пальця". Ендоскопічна картина ішемічного коліту характеризується різко окресленими межами ураження, підслизовими крововиливами, псевдополіпозними утвореннями синюшного кольору, що виступають у просвіт кишки. Гістологічне дослідження дозволяє виявити клітини гемосидерину і фіброз. Відсутність контактної кровоточивості на момент проведення біопсії також більше свідчить на користь ішемічного коліту. Лікування. Відсутність єдиного етіологічного фактора та складність патогенезу неспецифічного виразкового коліту ускладнюють лікування цього захворювання. Застосовують препарати, що мають протизапальну та антибактеріальну дію: салазопіридазин, сульфасалазин, салазодиметоксин, салофальк. Прийнятий внутрішньо сульфасалазин за участю кишкової мікрофлори розпадається на 5-аміносаліцілову кислоту і сульфапіридин. Неабсорбований сульфапіридин пригнічує в кишечнику зростання анаеробної мікрофлори, у тому числі клостридій та бактеріодів. А завдяки 5-аміносаліцилової кислоти препарат не лише викликає зміни у кишковій мікрофлорі, а й модулює імунні реакції, блокує медіатори запального процесу. Призначають препарат у дозі 2-6 г на добу протягом усього періоду активного запалення. При стиханні колітичного синдрому дозу сульфасалазину зменшують поступово, доводячи до підтримуючої (в середньому по 1-1,5 таблетки на день). Призначення похідних 5-аміносаліцилової кислоти (салофальк, мезакол, салосан, тидикол) є базовим методом і може бути використане у вигляді монотерапії при легкій та середньотяжкій формах виразкового коліту. Лікування проводиться на тлі дієтотерапії з винятком молочних продуктів, за наявності в раціоні збалансованого вмісту білків, жирів, вуглеводів та вітамінів. Свіжі фрукти, овочі, консерви доцільно виключити. Їжа має бути механічно і хімічно щадною. Живлення дробове 4-5 разів на добу. Вітамінний дисбаланс порушує процес всмоктування мікроелементів та заповнюється призначенням комплексних таблетованих препаратів ("Дуовіт", "Оліговіт", "Юнікап"). При вираженому діарейному синдромі в осіб з легким та середньо-тяжким перебігом захворювання показано призначення сандостатину, який інгібує синтез гастроінтестинальних гормонів та біогенних амінів (вазоактивного інтестинального пептиду, гастрину, серотоніну), продукція яких різко підвищена при виразковому коліті та хворобах. А також препарат зменшує секрецію та покращує всмоктування у кишечнику, пригнічує вісцеральний кровотік та знижує моторику. При застосуванні сандостатину (протягом 7 днів у дозі 0,1 мг 2 рази підшкірно) зменшується діарея, практично зникають тенезми, знижується виділення крові з калом. При тяжкій формі неспецифічного виразкового коліту лікування проводиться на тлі парентерального харчування. Вміст білка у цих препаратах має становити приблизно 1,5-2,0 г/кг маси тіла. Патогенетичним засобом терапії при тяжкій формі хвороби є кортикостероїди, які вводяться парентерально: протягом першої доби преднізолон вводять внутрішньовенно з інтервалом 12 год (90-120 і більше мг), у наступні 5 діб – внутрішньом'язово, поступово знижуючи дозу. При позитивному ефекті переходять на пероральний прийом препаратів (Преднізолон 40 мг на добу). Тривале призначення гормонів у період стійкої ремісії є недоцільним. У пацієнтів з тяжким перебігом захворювання відмічено позитивний ефект від проведення гіпербаричної оксигенації (ГБО). Застосування курсу ГБО (7-10 процедур) під час ремісії дозволяє знизити частоту рецидивів. Показання до екстреного хірургічного лікування: перфорація кишечника, токсична дилатація, профузна кишкова кровотеча, малігнізація. При середньотяжкій формі перебігу неспецифічного виразкового необхідна строга дієта з обмеженням клітковини, молочних продуктів та підвищеним вмістом білка. Преднізолон призначають внутрішньо у початковій дозі 20-40 мг на добу. До лікування можна додавати сульфасалазин та його аналоги, які приймають внутрішньо або вводять у мікроклізмах та свічках у пряму кишку. Початкова доза сульфасалазину – 1 г на добу, потім її збільшують до 4-6 г. Як допоміжний метод лікування можуть бути застосовані відвари трав, що мають протизапальну та гемостатичну дію (корінь кровохлібки, лист кропиви, лишайник, шишки сірої вільхи, корінь солодки), фітотерапія нерідко дозволяє зменшити дозу салазопрепаратів, продовжити ремісію. Прогноз і профілактика. При тяжкому перебігу та наявності системних та місцевих ускладнень прогноз серйозний. Хворі абсолютно непрацездатні. При легкій та середньотяжкій формах хвороби прогноз для життя сприятливий. Пацієнти потребують переведення на легку працю. У період ремісії рекомендується підтримуюче лікування салазопрепаратами, бактеріальними засобами, психотерапія, дієтотерапія. Хворі, які тривалий час страждають на неспецифічний виразковий коліт (більше 5-7 років), повинні бути віднесені до групи ризику виникнення раку кишечника і поставлені на диспансерний облік. Цим пацієнтам показано 1 раз на рік колоноскопію з прицільною біопсією. Лекція № 15. Хвороби нирок. Гострий гломерулонефрит Гострий гломерулонефрит (ОГН) – гостре дифузне захворювання нирок інфекційно-алергічної природи, що локалізується у клубочках. ОГН може бути самостійним захворюванням (первинний) або мати вторинний характер у складі іншого захворювання, ускладнюючи клінічну картину та діагностику останнього. ОГН хворіють, як правило, чоловіки молодого та середнього віку. Етіологія. ОГН виникає найчастіше після перенесеної кокової інфекції (грипу, гострих ангін, фарингітів, спричинених так званими нефритогенними штамами мікроорганізмів). У 60-80% хворих виявляється β-гемолітичний стрептокок групи А, в 1/3 випадків етіологію ОГН встановити не вдається. Тривале переохолодження, особливо в умовах підвищеної вологості, сприяє розвитку ОГН. Одним із факторів виникнення хвороби також є вакцинація, причому у 75 % випадків нирки уражаються після другої чи третьої ін'єкції. Патогенез. Патогенез захворювання має імунний механізм: при попаданні в організм антигенів (стрептококових, лікарських, чужорідних білків) у відповідь утворюються антитіла, що зв'язують ці антигени і разом з 3-ї фракцією комплементу утворюють імунні комплекси, що циркулюють в судинному руслі. Комплекси здатні відкладатися на зовнішній стороні базальної мембрани капілярів клубочків, викликаючи їх ураження за допомогою виділення продуктів розщеплення комплементу, що підвищують проникність капілярів і викликають локальні зміни останніх. До місць відкладення імунних комплексів спрямовуються нейтрофіли, лізосомальні ферменти яких посилюють пошкодження ендотелію та базальної мембрани, відокремлюючи їх один від одного. Дегрануляція тромбоцитів викликає звільнення серотоніну, що призводить до гемокоагуляції та відкладення фібрину на базальній мембрані. Елімінації імунних комплексів з організму сприяє макрофагальна реакція у вигляді проліферації клітин мезангію та ендотелію, при ефективності даного процесу настає одужання. клінічна картина. Клінічна картина захворювання складається із наступних синдромів. Сечовий синдром. 1. Протеїнурія внаслідок проходження молекул білка через простору стінки капіляра клубочка, що утворився під час осадження ними імунних комплексів. Протеїнурія носить селективний характер, коли через гломерулярний "фільтр" проходять переважно альбуміни. 2. Гематурія внаслідок залучення до патологічного процесу мезангії капілярів та інтерстиціальної тканини. Еритроцити проникають через найдрібніші розриви базальної мембрани, змінюючи свою форму. 3. Циліндрурія - виділення із сечею циліндричних клітин канальців. При дистрофічних процесах в канальцях з клітин клітин ниркового епітелію, що розпалися, утворюються зернисті циліндри, що складаються з щільної зернистої маси; воскоподібні циліндри мають різкі контури та гомогенну структуру; гіалінові циліндри є білковими утвореннями. Гіпертонічний синдром спостерігається внаслідок: 1) затримки натрію та води; 2) активації ренін-ангіотензин-альдостеронової та симпатоадреналової систем; 3) зниження функції депресорної системи нирок. Набряковий синдром пов'язують із наступними факторами: 1) зниженням клубочкової фільтрації внаслідок їх ураження; 2) зменшенням фільтраційного заряду натрію та підвищенням його реабсорбції; 3) затримкою води внаслідок затримки в організмі натрію; 4) збільшенням ОЦК; 5) вторинним гіперальдостеронізмом; 6) підвищенням секреції АДГ та збільшенням чутливості дистальних відділу нефрону до нього, що призводить до затримки рідини; 7) підвищенням проникності стінок капілярів та виходом плазми в тканині; 8) зниженням онкотичного тиску плазми при масивній протеїнурії. Скарги, які пред'являються при ОДН, малоспецифічні та зустрічаються при різних захворюваннях. Дуже важлива вказівка в анамнезі на нещодавно перенесену ангіну, загострення хронічного тонзиліту, переохолодження і т. д. Деякі хворі відзначають зменшення виділення сечі у поєднанні з деякою набряклістю (пастозністю) обличчя в ранковий час. У 1/3-3/4 хворих у перші дні хвороби відзначаються не дуже сильні, ниючі болі в ділянці нирок, пов'язані зі збільшенням розмірів нирок. Також спостерігаються підвищена стомлюваність, біль голови, задишка при фізичному навантаженні, короткочасне підвищення температури тіла до субфебрильної. Артеріальна гіпертензія, що виявляється лише у половини хворих, характеризується підвищенням цифр до 140-160/85-90 мм рт. ст. (рідко – до 180/100 мм рт. ст.). Діагностика. У 100% випадків при дослідженні сечі діагностуються протеїнурія різного ступеня вираженості, циліндрурія і, що має найбільше значення для діагностики, гематурія різного ступеня вираженості - від мікрогематурії (до 10 еритроцитів у полі зору) до макрогематурії (хоч і досить рідкісної). Однак при підозрі на ОДН необхідно провести серію повторних досліджень сечі або поставити пробу Нечипоренка (визначення кількості формених елементів 1 мкл), оскільки в одноразовій порції сечі еритроцитів можна не виявити. При дослідженні крові виявляються острофазові показники (підвищення вмісту фібриногену та α2-глобуліну, С-реактивного білка, прискорення ШОЕ), кількість лейкоцитів змінюється мало, помірна анемія. При неускладненому перебігу ОГН вміст у крові азотистих речовин (креатиніну, індикану, сечовини) не змінюється. У початковій фазі хвороби спостерігається зміна проби Реберга - зниження клубочкової фільтрації та підвищення канальцевої реабсорбції, що нормалізується в міру одужання. При рентгенологічному дослідженні у хворих з вираженою артеріальною гіпертензією може спостерігатися помірне збільшення лівого шлуночка, який приймає колишні розміри в міру одужання хворого. Виділяють 3 клінічні варіанти ОПН. 1) Моносимптомний варіант: незначні скарги, відсутність набряків та артеріальної гіпертензії, є лише сечовий синдром; найчастіший варіант перебігу захворювання (86% випадків). 2) Нефротичний варіант: виражені набряки, олігурія, можливе підвищення артеріального тиску до відносно невисоких цифр, виявляється у 8% хворих. 3) Розгорнутий варіант: артеріальна гіпертензія, що досягає високих цифр (180/100 мм рт. ст.), помірно набряки, недостатність кровообігу, зустрічається в 6% випадків. Диференціальна діагностика. ОГН необхідно відрізняти від хронічного гломерулонефриту, що не становить складнощів при гострому початку ОГН і подальшому повному зворотному розвитку симптомів. Однак за відсутності гострого початку, а також за тривалого збереження окремих ознак хвороби діагностика суттєво ускладнюється. При складнощі диференціації вдаються до пункційної біопсії нирки. Важко диференціювати ОПН від пієлонефриту через наявність лейкоцитурії при обох захворюваннях. Однак ОДН супроводжується більш масивною протеїнурією і в ряді випадків – набряками. Диференціальній діагностиці допомагають також клінічні симптоми пієлонефриту у вигляді більш виражених болів у попереку, що супроводжуються підвищенням температури тіла та дизуричними розладами. Діагностичну цінність має також визначення при пієлонефриті бактеріурії, виявлення "активних" лейкоцитів, а також рентгенологічне (деформація чашок) та ізотопно-ренографічне (асиметрія функції нирок) дослідження. ОГН як самостійне захворювання необхідно диференціювати від хронічних дифузних захворювань сполучної тканини, у яких ОГН одна із проявів хвороби. Така ситуація зазвичай виникає при вираженості сечового, гіпертензивного та набрякового синдромів і недостатній чіткості інших симптомів захворювання, частіше при ВКВ (системному червоному вовчаку). Правильний діагноз при ВКВ дозволяють поставити облік суглобового синдрому, ураження шкіри та інших органів (серця), виражених імунологічних зрушень (виявлення протиорганних антитіл у високому титрі, клітин червоного вовчаку, антитіл до ДНК та РНК), а також спостереження за динамікою клінічної картини. Лікування. Лікування при ОГН комплексне і включає наступні заходи. 1. Режим. При підозрі на ОДН або відразу після встановлення діагнозу хворий має бути негайно госпіталізований. Суворий постільний режим необхідно дотримуватись близько 2-4 тижнів до ліквідації набряків та нормалізації артеріального тиску. Перебування в ліжку забезпечує рівномірне зігрівання тіла, що веде до зменшення спазму судин (отже, до зниження артеріального тиску) та до збільшення клубочкової фільтрації та діурезу. Після виписки зі стаціонару показано домашнє лікування до 4 місяців з дня початку захворювання, що є найкращою профілактикою переходу ОПН у хронічну стадію. 2. Дієта. Залежно від вираженості клінічної симптоматики дуже важливим є обмеження рідини та кухонної солі. При розгорнутій та нефротичній формі рекомендують протягом 1-2 днів повний голод із споживанням рідини у кількості, що дорівнює діурезу. На 2-3 день показано споживання їжі, багатої солями калію (рисової каші, картоплі). Загальна кількість випитої води на добу має дорівнювати обсягу виділеної за попередню добу сечі плюс 300-500 мл. Через 3-4 дні хворого переводять на дієту з обмеженням білка (до 60 г на добу), а загальна кількість солі – не більше 3-5 г на добу. Такої дієти рекомендується дотримуватися до зникнення всіх позаниркових симптомів та різкого поліпшення сечового осаду. 3. Лікарська терапія включає насамперед антибактеріальну терапію, яку, проте, слід проводити лише у разі достовірності встановлення інфекційної природи ОГН (збудник виділено і з початку захворювання пройшло трохи більше 3 тижнів). Зазвичай призначають пеніцилін або його напівсинтетичні аналоги у загальноприйнятих дозах. Наявність явних вогнищ хронічної інфекції (тонзиліту, гаймориту тощо) також є прямим показанням до проведення антибактеріальної терапії. Сечогінні засоби в терапії ОПН показані лише при затримці рідини, підвищенні артеріального тиску та появі серцевої недостатності. Найбільш ефективний фуросемід (40-80 мг), що застосовується до ліквідації набряків та артеріальної гіпертензії. Немає потреби у тривалому призначенні даних препаратів, достатньо 3-4 прийомів. За відсутності набряків, але гіпертензії, що зберігається, або при недостатньому антигіпертензивному ефекті салуретиків призначають гіпотензивні препарати (клофелін, допегіт) з тривалістю прийому, що залежить від стійкості артеріальної гіпертензії. При нефротичній формі ОПН призначають імуносупресивну терапію (кортикостероїди – преднізолон по 60-120 мг на добу з подальшим поступовим зниженням дози, тривалістю застосування протягом 4-8 тижнів). При ОГН із вираженими набряками та значним зниженням діурезу вводять гепарин по 20 000-30 000 ОД на добу протягом 4-6 тижнів, домагаючись збільшення часу зсідання крові у 2-3 рази. При протеїнурії, що затягнулася, призначають індометацин або вольтарен по 75-150 мг на добу (при відсутності гіпертензії та олігурії). Прогноз сприятливий, проте при формах, що затягнулися, є ймовірність переходу процесу в хронічний. Профілактика ОПН зводиться до ефективного лікування осередкової інфекції, раціонального загартовування. З метою своєчасного виявлення початку хвороби після вакцинації, перенесених на ГРВІ у всіх хворих необхідно обов'язково дослідити сечу. Лекція № 16. Хвороби нирок. Пієлонефрит Пієлонефрит - це інфекційне захворювання, при якому в процес залучається ниркова балія, її чашки та речовина нирок з переважним ураженням проміжної тканини. У зв'язку з цим пієлонефрит є інтерстиціальним (проміжним) нефритом. Це ширше поняття, ніж пієлонефрит. Воно позначає, по-перше, вид запалення нирок будь-якої етіології з переважним залученням інтерстицію, по-друге, особливе захворювання, при якому це запалення є єдиним та основним його виразом. Близький до проміжного нефриту так званий тубуло-інтерстиціальний нефрит, при якому має місце співдружня поразка канальців та строми нирок. Класифікація. На підставі клініко-морфологічних даних розрізняють гострий і хронічний пієлонефрит, який зазвичай має рецидивуючий перебіг у вигляді атак гострого пієлонефриту. Також пієлонефрит може бути одно- та двостороннім. За формою перебігу (для хронічного пієлонефриту): рецидивна форма, латентний хронічний пієлонефрит, пієлонефритична зморщена нирка. Етіологія і патогенез. Пієлонефрит – інфекційне захворювання. Його збудниками служать інфекційні агенти неспецифічної природи: кишкова паличка, ентерокок, стафілокок та інші бактерії, проте в більшості випадків йдеться про кишкову паличку (40 %) і змішану флору (38 %). Звертається увага на L-форми бактерій, протопласти (тіла бактерій, позбавлені оболонок, здатні підтримувати інфекцію), кандиди, які можуть спричинити хронічний пієлонефрит. Джерелами інфекції можуть бути тонзили, захворювання статевих органів і товстого кишечника, тобто інфекційні агенти можуть проникати в нирку, в тому числі і балію, зі струмом крові (гематогенний низхідний пієлонефрит), що спостерігається при багатьох інфекційних захворюваннях (черевному тифі, грипі , ангіні, сепсисі). Найчастіше мікроби заносяться в нирки висхідним шляхом з сечоводів, сечового міхура, сечовипускального каналу (урогенный висхідний пієлонефрит), якому сприяють дискінезія сечоводів і балії, підвищення внутрішньолоханкового тиску (везикоренальний і пієлоренальний рефлюкси), а також пієловенозний рефлюкс). Висхідний пієлонефрит, як правило, ускладнює ті захворювання сечостатевої системи, при яких утруднений відтік сечі (камені та стриктури сечоводів, стриктури сечівника, пухлини сечостатевої системи), тому він часто розвивається і під час вагітності. Можливе і лімфогенне занесення інфекції в нирки (лімфогенний пієлонефрит), коли джерелом інфекції є товста кишка та статеві органи. Для розвитку пієлонефриту, крім проникнення інфекції в нирки, велике значення мають реактивність організму та низка місцевих причин, що зумовлюють порушення відтоку сечі та сечовий стаз. Цими причинами пояснюється можливість рецидивуючого хронічного перебігу хвороби. Мікроорганізми, що потрапили при функціональних і морфологічних змінах сечових шляхів, що ведуть до стазу сечі, порушеннях венозного і лімфатичного відтоку з нирки, що сприяють фіксації інфекції в нирках, викликають вогнищеві та поліморфні зони запальних інфільтратів і нагноєння і інтерстиція однієї. Уражається інтерстиціальна тканина канальців, та був і нефронів. Виникають продуктивний ендартеріїт, гіперплазія середньої оболонки судин, розвиваються явища гіалінозу, артеріолосклерозу до вдруге зморщеної нирки. В останні роки певна роль у розвитку хронічного пієлонефриту відводиться аутоімунним реакціям: під впливом бактеріальних антигенів на базальній мембрані клубочкових капілярів відкладаються імуноглобулін G та комплемент, що спричиняє її пошкодження. Переходу гострого пієлонефриту в хронічний сприяють запізніла діагностика гострого пієлонефриту, невчасна госпіталізація, наявність хронічних інфекцій, цукрового діабету, подагри, зловживання анальгетиками – фенацетином. Хронічний пієлонефрит частіше зустрічається у жінок (50%), чому сприяють вагітності, особливо повторні (естрогени викликають атонію гладких м'язів сечових шляхів), у дитячому віці у дівчаток, що пов'язано із будовою сечових шляхів, їх аномаліями. клінічна картина. Як зазначалося вище, можливо як гостре, і хронічний перебіг пієлонефриту. Клінічна картина гострої фази захворювання характеризується раптовим, різким підвищенням температури тіла до 39-40 ° C, виникненням слабкості, головного болю, ознобу, що поєднується з рясним потовиділенням, можлива поява нудоти та блювання. Нарівні з підйомом температури тіла з'являються болі в ділянці нирок, які, як правило, відзначаються з одного боку. Характер болю тупий, їх інтенсивність різна. У разі розвитку захворювання на тлі сечокам'яної хвороби атаці пієлонефриту передує напад ниркової кольки. За відсутності адекватної терапії захворювання може перейти в хронічну форму, або це призводить до розвитку нагножувальних процесів нирки, які клінічно проявляються погіршенням загального стану хворого та різкими стрибками температури (від 35-36 ° C вранці до 40-41 ° C увечері). Хронічний пієлонефрит є, як правило, наслідком нелікованого гострого пієлонефриту, коли зняти гостре запалення виявилося можливим, але не вдалося ні радикально знищити всіх збудників у нирці, ні відновити фізіологічний відтік сечі з нирки. Хронічний пієлонефрит турбує постійними тупими ниючими болями в ділянці нирок, що посилюються в сиру холодну погоду. Також хронічний пієлонефрит схильний до періодичних загострень, коли у хворого з'являються всі ознаки гострого процесу. Діагностика. Проблема діагностики захворювання пов'язана з тим, що симптоми пієлонефриту подібні до симптомів інших захворювань, що виникають внаслідок запалення сечопровідних шляхів. План діагностичного обстеження включає аналізи крові, сечі, а також дослідження, що показують стан сечовивідної системи: УЗД нирок, рентгенівські дослідження, ПЛР-аналіз на інфекційний агент. Для верифікації виду інфекційного збудника необхідно провести бактеріологічне посів проби сечі, а метод комп'ютерної томографії використовується для виключення пухлинних процесів. Таким чином, для розпізнавання захворювання велике значення мають лабораторні та спеціальні методи дослідження. А при хронічному пієлонефриті вирішальними, а часом і єдиними проявами є зміни з боку сечі, крові та сечовивідних шляхів. Необхідне динамічне спостереження за артеріальним тиском та вагою хворого. У крові відзначаються лейкоцитоз, збільшена ШОЕ, нейтрофільйий зсув, можливе підвищення рівня залишкового азоту (при нормі 20-40 мг), сечовини (норма 40-60 мг), креатиніну (норма 53-106 мкмоль/л), індикану (норма 1,41, 3,76-180 мкмоль/л), холестерину (норма 200-83 мг), хлоридів крові (норма XNUMX ммоль/л). Важливі для діагностики зміни з боку сечі: зниження частки, протеїнурії (у тому числі добової), гематурії та циліндрурії. Проте дедалі більшого діагностичного значення набувають методи кількісного визначення формених елементів осаду сечі: Яковського-Аддіса (у нормі лейкоцитів до 4 млн. еритроцитів - до 1 млн., циліндрів - до 2 тис. за 24 год), Амбюрже (у нормі лейкоцитів до 2000) , еритроцитів – до 1400, циліндрів – до 20 за 1 хв), Нечипоренко (в нормі лейкоцитів до 2500, еритроцитів – до 1000, циліндрів – до 20 в 1 мл свіжовипущеної сечі). Співвідношення абсолютного числа еритроцитів та лейкоцитів в осаді сечі при пієлонефриті різко змінюється у бік значного переважання лейкоцитів у 10-20 разів. При хронічному пієлонефриті в сечі з'являються клітини Штенгеймера-Мальбіна: великі лейкоцити, з броунівським рухом гранул цитоплазми, що з'являються при зниженні осмотичних властивостей сечі (питомої ваги нижче 10-14), фарбуються генціанвіолетом , що володіють броунівським рухом протоплазми, що виявляються при фарбуванні 1% водним розчином метиленового синього з додаванням дистильованої води. Наголошується на діагностичному значенні збільшення кількості "активних" лейкоцитів і клітин Штенгеймера-Мальбіна (до 40 %), бактеріурії (мікробне число понад 100 тис. на 1 мл сечі), нітрит-тесту (при мікробному числі понад 100 тис. ОД мікроби розкладають нітрити сечі , при додаванні сульфанілової кислоти і L-нафтиламіну з'являється червоне фарбування), колориметричного ТТХ-тесту (під дією дегідрогеназ мікробів трифенілтетразоліт хлорид відновлюється в червоний нерозчинний трифенілформазан протягом 4-10 год при температурі -37 °C) у стерильний посуд середню порцію сечі - контрольну, потім у вену повільно вводиться 30 мг преднізолону в 10 мл фізіологічного розчину і збирається середня порція сечі тричі з годинними інтервалами і через 24 год; при хронічному пієлонефриті кількість лейкоцитів" , хоча в одній порції), антибіотикограми. Особливо слід зупинитися на мікроскопії туберкульозу нирок (мікроскопія мазків, пофарбованих по Цилю, посів сечі на спеціальні середовища - метод Прейс та Школярової, біологічний метод). При підозрі на односторонній процес необхідно проводити дослідження сечі, яка окремо взята з кожної нирки спеціальними катетерами. Велику роль у діагностиці хронічного пієлонефриту відіграють рентгенологічні методи дослідження: оглядова рентгенографія та томографія (характеризують положення, величину та форму нирок), екскреторна та ретроградна пієлографія (зменшення концентраційної та видільної здатності нирок, спазми, аномалії, деневації) розпізнавання неконтрастного каміння), ниркова ангіографія (виявляє порушення судинної архітектоніки - артерій та вен). Для визначення збереження функції, і паренхіми нирок, особливо при односторонньому процесі, застосовують радіоіндикаційні методи - ренографія (гіппуран йод 131) і сканографія (за допомогою неогідриду Hg 203). Пункційна біопсія у разі пієлонефриту у зв'язку з осередковістю процесу може не дати інформації. Про ураження нирок може свідчити хромоцистоскопія. Лікування. Найчастіше терапія пієлонефриту консервативна, проте при гнійному характері гострого пієлонефриту, можливо, буде потрібно оперативне втручання. Консервативне лікування складається з режиму, дієти, застосування антибіотиків, а також різних препаратів, що стабілізують функцію нирок та організму хворого загалом. При гострому пієлонефриті показаний суворий постільний режим. У харчування повинні вживатися продукти, що містять оптимальну кількість білків, жирів та вуглеводів. У гострий період необхідно чергувати білкову та рослинну їжу. При вираженій інтоксикації необхідне питво. Лікування хронічного пієлонефриту складається з впливу на інфекцію (етіотропне) при первинному пієлонефриті та на усунення тієї чи іншої причини при вторинному пієлонефриті, патогенетичні механізми та лікування ускладнень. Найбільш ефективним є лікування після визначення антибіотикограми. Проводиться безперервне (щонайменше 2 місяців) лікування антибактеріальними препаратами. Відразу при вступі призначаються антибіотик, сульфаніламідний або нітрофурановий препарат. Через 1-10 днів препарати змінюють, лікування проводять до стійкого зникнення лейкоцитурії та бактеріурії. Як тільки загострення ліквідовано, проводять протягом 4-5 місяців переривчасте лікування одним із антибактеріальних засобів: препарат дають 7 днів, потім роблять перерву на 8-10 днів, або препарат дають 10 днів з інтервалом у 15-20 днів, або препарат дають 15 днів, інтервал роблять на 15 днів, потім призначають знову протимікробну терапію. Тривалість лікування та інтервалів визначається клінічними симптомами та лабораторним контролем. Слід зазначити, що при пієлонефриті, що розвинувся у хворого на хронічний тонзиліт, найбільш ефективні антибіотики пеніцилінового ряду, при інфекції геніталій у чоловіків і жінок застосовуються антибіотики широкого спектра дії (див. табл. 12). За наявності грамнегативної флори хороші результати дає лікування налідиксовою кислотою (неграм, ієвіграмон – 1,0 г по 4 рази на добу протягом 7 днів, але її препарати слід призначати рідше, ніж інші засоби (2 рази)). З сульфаніламідних препаратів застосовуються етазол (1,0 г по 4 рази – 10 днів), солафур (0,1 г 3 рази), сульфаніламіди пролонгованої дії. Також курсами проводять лікування фуразолідоном, фурадоніном, фурагіном (0,1 г 4 рази на день). Необхідно наголосити, що до початку лікування слід визначити функцію нирок. Тривалу антибактеріальну терапію доцільно проводити при клубочковій фільтрації не нижче 30 мл/хв або за вмісту залишкового азоту в сироватці крові не більше 70 мг. Показником ефективності препарату після тижневого лікування є зменшення мікробного числа до 10 000 на 1 мл сечі. Зменшити вірулентність мікрофлори та збільшити ефективність антибактеріальних засобів можна шляхом зміни реакції сечі кожні 10-14 днів. Зменшити реакції рН допомагають лужна їжа, лимоннокислий натрій (10 г на добу), лужні мінеральні води. Деякою антибактеріальною дією має бензойнокислий натрій (4-6 г на добу), якого багато в журавлині та мучниці. Патогенетична терапія має бути спрямована на підвищення реактивності організму, покращення відтоку сечі, нормалізацію артеріального тиску. Для активізації імунобіологічної реактивності використовують α-глобулін, аутогемотерапію, переливання крові, вакцинотерапію (лікування аутовакциною проводять протягом 30-40 днів по 0,1 мл підшкірно або по 0,2-0,3 мл через кожні 2 дні), стафілококовий анатоксин ( 0,1-0,3-0,5-0,7-1,0-1,2-1,7-2,0 мл через кожні 3 дні). Нормалізувати відтік сечі допомагають сечогінні трави (мучниця, плоди ялівцю, польовий хвощ, лист ортосифону - нирковий чай, лист брусниці), спазмолітики (папаверин, но-шпа та ін). За наявності перешкоди току сечі показано оперативне лікування. При супутній захворюванню на гіпертензію показані препарати раувольфії - ізобарин, допегіт, гемітон, салуретики, антагоністи альдостерону. Профілактика та прогноз. Профілактика пієлонефриту складається з первинних та вторинних заходів. До первинної профілактики можна віднести, насамперед, лікування захворювань, які можуть призвести до розвитку пієлонефриту: осередкових інфекцій, урологічних захворювань (таких як сечокам'яна хвороба, аденома простати, а також будь-які захворювання, що супроводжуються порушенням відтоку сечі з нирки), оздоровчі заходи. Таблиця 12 Порівняльна ефективність антибактеріальних препаратів при пієлонефриті
Вторинна профілактика включає виявлення бактеріурії при профілактичних оглядах (наприклад, вагітним жінкам необхідно не рідше 1 разу на місяць проводити бактеріологічний аналіз сечі), призначення протирецидивного лікування: перший тиждень кожного місяця – пауза в лікуванні: відвар шипшини, другий, третій тиждень – рослинні діуре антисептики, четвертий тиждень - антибактеріальні засоби (нітрофурани, антибіотики, антисептики, 1 раз на рік - невіграмон 1,0 г 4 рази протягом тижня та 2 г - протягом другого тижня, або 5-НОК 100-150 мг 4 рази на день 10-12 днів). Протирецидивне лікування проводиться 2-3 роки. Диспансерні огляди з лікуванням повинні доводитися 3-4 рази на рік або 4-6 разів. Прогноз. Прогноз залежить від стадії захворювання. Санаторно-курортне лікування. Санаторно-курортне лікування показано в період ремісії, особливо хворим на вторинний калькульозний пієлонефрит після урологічних операцій (Трускавець, Саїрме, Залізноводськ, Березівські мінеральні води), де хворі приймають маломінералізовані води. Санаторно-курортне лікування протипоказане при високій гіпертензії, вираженій анемії та явній нирковій недостатності. Ускладнення пієлонефриту різноманітні. При гострому пієлонефриті прогресування гнійного процесу веде до злиття великих абсцесів та утворення карбункулу нирки, повідомлення гнійних порожнин з балією (піонефроз), переходу процесу на фіброзну капсулу (перинефрит) та навколониркову клітковину (паранефрит). Гострий пієлонефрит може ускладнитися некрозом сосочків пірамід (папілонекроз), що розвиваються внаслідок прямої токсичної дії бактерій в умовах сечового стазу. Це ускладнення пієлонефриту зустрічається здебільшого у хворих на діабет. Рідко пієлонефрит стає джерелом сепсису. При обмеженні гнійного процесу під час рубцювання можуть утворитися абсцеси, оточені піогенною мембраною (хронічний абсцес нирки). При хронічному пієлонефриті, особливо односторонньому, можливий розвиток нефрогенної гіпертонії та артеріолосклерозу у другій (інтактній) нирці. Двостороннє пієлонефритичне зморщування нирок веде до хронічної ниркової недостатності. Результатом гострого пієлонефриту зазвичай є одужання, але внаслідок ускладнень (піонефрозу, сепсису, папілонекрозу) може настати смерть. Хронічний пієлонефрит із зморщуванням нирок нерідко закінчується азотемічною уремією. При розвитку артеріальної гіпертонії ренального походження летальний кінець при хронічному пієлонефриті іноді пов'язаний з тими ускладненнями, які зустрічаються при гіпертонічній хворобі (крововиливи в мозок, інфаркт міокарда та ін). Автор: Мостова О.С.
▪ Медична статистика. Конспект лекцій
Новий спосіб управління та маніпулювання оптичними сигналами
05.05.2024 Приміальна клавіатура Seneca
05.05.2024 Запрацювала найвища у світі астрономічна обсерваторія
04.05.2024
▪ У мідному глечику може вижити тільки старий Хоттабич
▪ розділ сайту Акумулятори, зарядні пристрої. Добірка статей ▪ стаття Чи буду в фатальний час ганьбити громадянина сан? Крилатий вислів ▪ стаття Як давно і за яких обставин з'явилася копійка? Детальна відповідь ▪ стаття Орляк звичайний. Легенди, вирощування, способи застосування ▪ стаття Стандартні люмінесцентні лампи Маркування. Енциклопедія радіоелектроніки та електротехніки ▪ стаття Порваний папір стає цілим (два способи). Секрет фокусу
Головна сторінка | Бібліотека | Статті | Карта сайту | Відгуки про сайт www.diagram.com.ua |






 Arabic
Arabic Bengali
Bengali Chinese
Chinese English
English French
French German
German Hebrew
Hebrew Hindi
Hindi Italian
Italian Japanese
Japanese Korean
Korean Malay
Malay Polish
Polish Portuguese
Portuguese Spanish
Spanish Turkish
Turkish Ukrainian
Ukrainian Vietnamese
Vietnamese








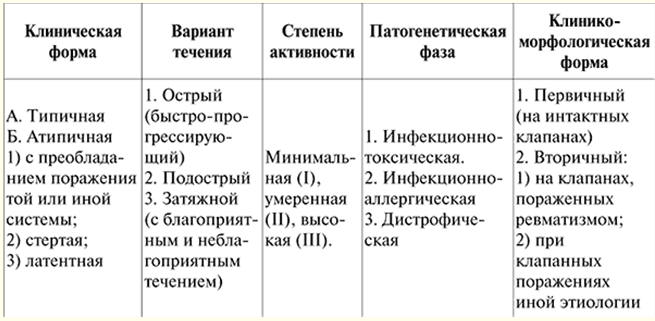








 Дивіться інші статті розділу
Дивіться інші статті розділу 