
|
КОНСПЕКТИ ЛЕКЦІЙ, ШПАРГАЛКИ
Госпітальна терапія. Шпаргалка: коротко, найголовніше
Довідник / Конспекти лекцій, шпаргалки Зміст
1. Ревматизм. Етіологія та патогенез Ревматизм (хвороба Сокольського-Буйо) - це системне запальне захворювання сполучної тканини з переважною локалізацією процесу в серцево-судинній системі, яке розвивається у схильних до нього осіб (як правило, це особи молодого віку) у зв'язку з гострою інфекцією b-гемолітичним стрептококом групи А. Це визначення хвороби було дано 1989 р. В. А. Насоновим. Поразка інших органів та систем при ревматизмі має другорядне значення і не визначає його тяжкості та подальшого прогнозу. Етіологія. Бета-гемолітичні стрептококи групи А є причиною ураження верхніх дихальних шляхів. Саме тому виникненню ревматизму, як правило, передують ангіна, загострення хронічного тонзиліту, а в крові у хворих виявляється підвищена кількість стрептококового антигену та протистрептококових антитіл (АСЛ-О, АСГ, АСК, антидезоксирибонуклеази В) (анти-ДНКази В). У розвитку ревматизму відіграють роль вікові, соціальні фактори (несприятливі побутові умови, недостатнє харчування), має значення і генетична схильність (ревматизм - полігенно успадковане захворювання, добре відомо існування "ревматичних" сімей), яка полягає в гіперімунній відповіді на антигени стрептокока, схильності до аутоімунних та імунокомплексних процесів. Патогенез. При ревматизмі виникає складна та різноманітна імунна відповідь (реакції гіперчутливості негайного та уповільненого типів) на численні антигени стрептокока. При попаданні в організм інфекції виробляються протистрептококові антитіла та утворюються імунні комплекси (антигени стрептокока + антитіла до них + комплемент), які циркулюють у крові та осідають у мікроциркуляторному руслі. Токсини і ферменти стрептокока також надають шкідливу дію на міокард і сполучну тканину. Внаслідок генетично обумовленого дефекту імунної системи з організму хворих недостатньо повно та швидко елімінуються стрептококові антигени та імунні комплекси. В результаті розвиваються аутоімунні процеси на кшталт гіперчутливості уповільненого типу, і в крові хворих виявляються лімфоцити, що реагують із серцевою тканиною. Цим клітинам надають великого значення походження органних уражень (головним чином серця). У сполучній тканині при ревматизмі виникають фазові зміни: борошно набухання - фібриноїдні зміни - фібриноїдний некроз. Морфологічним виразом імунних порушень є клітинні реакції – інфільтрація лімфоцитами та плазмоцитами, утворення ревматичної, або ашоффталалаївської, гранульоми. Патологічний процес завершується склерозуванням. При поразці серця запальний процес може поширюватися попри всі оболонки серця (панкардит) чи ізольовано кожну з оболонок. 2. Клінічна картина ревматизму Всі прояви хвороби можна розділити на серцеві та позасерцеві. Описувати клінічну картину хвороби можна з цих позицій. І етап: виявляється зв'язок хвороби з перенесеною інфекцією. У типових випадках через 1-2 тижні після ангіни або гострого респіраторного захворювання підвищується температура тіла, іноді до 38-4 ° C, з коливаннями протягом доби в межах 1-2 C і сильним потом (зазвичай без ознобу). Найбільш частим проявом ревматизму є ураження серця – ревмокардит: одночасне ураження міокарда та ендокарда. Хворі пред'являють скарги на слабкі болі або неприємні відчуття в серці, легку задишку при навантаженні, значно рідше відзначають перебої або серцебиття. Ревмокардит у хворих молодого віку, як правило, протікає важко: від самого початку хвороби відзначаються сильна задишка при навантаженні та у спокої, постійні болі в ділянці серця, серцебиття. Перикардит так само, як і позасерцеві прояви ревматизму, зустрічається рідко. При розвитку сухого перикардиту хворі відзначають лише постійні болі у серці. При ексудативному перикардиті, що характеризується накопиченням у серцевій сумці серозно-фібринозного ексудату, біль зникає, оскільки відбувається роз'єднання запалених листків перикарда ексудатом, що накопичується. Найбільш характерним для ревматизму є ураження опорно-рухового апарату як ревматичного поліартриту. Ревматичні поразки нирок також дуже рідкісні, виявляються лише за дослідженні сечі. Абдомінальний синдром (перитоніт) зустрічається майже виключно у дітей та підлітків із гострим первинним ревматизмом. На ІІ етапі діагностичного пошуку невелике значення має виявлення ознак ураження серця. При первинному ревмокардиті серце зазвичай не збільшено. При аускультації виявляються приглушений I тон, іноді поява III тону, м'який шум систоли на верхівці. Ця симптоматика зумовлена змінами міокарда. У разі ураження клапана аорти може вислуховуватись протодіастолічний шум у точці Боткіна, а звучність II тону може зберігатися. У хворих на поліартрит відзначаються деформація суглобів за рахунок запалення синовіальної оболонки та навколосуглобових тканин, болючість при пальпації суглоба. Кільцеподібна еритема (ознака, практично патогномонічна для ревматизму) - зустрічається виключно рідко (у 1-2% хворих). На ІІІ етапі діагностичного пошуку дані лабораторно-інструментального дослідження дозволяють встановити активність патологічного процесу та уточнити ураження серця та інших органів. Острофазові показники: нейтрофілоз зі зсувом лейкоцитарної формули крові вліво; збільшення вмісту 2-глобулінів, що змінюється підвищенням рівня – глобулінів; підвищення вмісту фібриногену; поява С-реактивного білка; зростає ШОЕ. Імунологічні показники, підвищення титрів протистрептококових антитіл (антигіалуронідази та антистрептокінази більше 1: 300, анти-О-стрептолізину більше 1:250). 3. Діагностика ревматизму За поступового початку ревматизму має значення запропонована А. І. Нестеровим у 1973 р. (див. табл. 1) синдромна діагностика: клініко-епідеміологічний синдром; кардіоваскулярний синдром (див. табл. 2). Таблиця 1
Таблиця 2
4. Диференційна діагностика ревматизму Ревматичний поліартрит необхідно диференціювати з неревматичними (див. табл.). Таблиця
5. Лікування ревматизму Весь комплекс лікування ревматизму складається з протимікробної та протизапальної терапії, заходів, спрямованих на відновлення імунологічного гомеостазу. Рекомендується використання раціонального збалансованого харчування, спрямованість на адаптацію до фізичних навантажень, підготовка до трудової діяльності, своєчасне оперативне лікування пацієнтів зі складними вадами серця. Всім пацієнтам під час активної фази ревматизму показаний пеніцилін (1 200 000-1 500 000 ОД на 6 прийомів на день, кожні 4 години), що надає бактерицидну дію на всі типи А-стрептокока. Курс лікування – 2 тижні в період активної фази ревматизму, надалі потрібен переведення на пролонгований препарат біцилін-5 (1 ОД). При непереносимості пеніциліну можна призначати еритроміцин по 500 мг 000 рази на день. Препаратами з протизапальним ефектом, що застосовуються у сучасному лікуванні активної фази ревматизму, є глюкокортикостероїди, саліцилові, індольні похідні, деривати фенілоцтової кислоти та ін. Преднізолон застосовується по 20-30 мг на день (протягом 2 тижнів, потім доза знижується на 2,5-5 мг кожні 5-7 днів, всього на курс 1,5-2 місяці) при первинному та зворотному з ІІІ та ІІ ступенем активності процесу ревмокардиту, при полісерозитах та хореї, при розвитку серцевої недостатності внаслідок активного кардиту. Кортикоїдні засоби впливають на водно-сольовий обмін, тому при лікуванні повинні використовуватися хлорид калію по 3-4 г/добу, панангін та інші; -6 мг/добу, фуросемід по 8-40 мг/добу та ін), при ейфорії - транквілізатори та ін. Широко застосовуються при ревматизмі та нестероїдні протизапальні препарати: середні дози ацетилсаліцилової кислоти – 3-4 г на день, рідше 5 г на день та більше. Ацетилсаліцилову кислоту застосовують по 1 г 3-4 рази на добу після їди 1-3 місяці і більше при нормальній переносимості та при дотриманні контролю над побічними ефектами. Успішному застосуванню похідної індолоцтової кислоти – індометацину при ревматизмі вже понад 20 років. Він має виражений лікувальний ефект: зникають суб'єктивні симптоми кардиту (кардіалгії, серцебиття, задишка) вже до 8-10-го дня терапії, а об'єктивні ознаки - до 14-16-го дня. Ще швидше відбувається зникнення поліартриту та полісерозиту. При лікуванні ревматизму має значення поєднання трьох основних етапів: стаціонар – поліклініка – курорт. На І етапі здійснюють лікування препаратами, перерахованими вище. Після зменшення активності ревматизму та нормалізації стану хворого переводять на II етап – лікування у ревматологічному санаторії. Основна мета цього етапу – продовження лікування нестероїдними протизапальними препаратами. III етап включає диспансерне спостереження та профілактичне лікування. 6. Класифікація кардіоміопатії. Етіологія дилатаційної кардіоміопатії (ДКМП) Кардіоміопатії - первинні ізольовані ураження міокарда незапального характеру невідомої етіології (ідіопатичні), вони не мають зв'язку з клапанними вадами або внутрішньосерцевими шунтами, артеріальною або легеневою гіпертензією, ішемічною хворобою серця або системними захворюваннями (як то: колагенози, амілохромози,). причому у фінальній стадії хвороби розвиваються тяжка застійна серцева недостатність та складні порушення серцевого ритму та прохідності. Класифікація кардіоміопатій: 1) дилатаційна кардіоміопатія: а) ідіопатична; б) токсична; в) інфекційна; г) при колагенозах; 2) гіпертрофічна; 3) рестриктивна; 4) аритмічна дисплазія правого шлуночка; 5) поєднання одного з чотирьох видів кардіоміопатій з артеріальною гіпертензією. Дилатаційна кардіоміопатія (ДКМП) – захворювання серцевого м'яза, що характеризується дифузним розширенням всіх камер серця (переважно лівого шлуночка), при якому на першому плані стоїть патологія насосної функції серця і як наслідок – хронічна серцева недостатність (звідси друга назва – застійна, коли серце не здатне повноцінно перекачувати кров і вона "застоюється" у тканинах та органах організму). М'язова стінка серця при цьому залишається або незміненою, або різною мірою гіпертрофується. Захворювання та фактори, що передували розвитку ДКМП, описані у наведеній нижче таблиці (див. табл.). Таблиця. Захворювання та фактори, що передували розвитку ДКМП
Це найпоширеніша форма ураження серцевого м'яза. Захворюваність становить 5-8 випадків на 100 000 чоловік на рік. Точного сімейного анамнезу у цих пацієнтів не простежується. Чоловіки хворіють у 2-3 рази частіше за жінок. 7. Патогенез дилатаційної кардіоміопатії (ДКМП) Патогенез. В результаті запального процесу в серцевому м'язі (міокардиту) відбувається загибель окремих клітин у різних її ділянках. Запалення у своїй носить вірусний характер, а клітини, уражені вірусом, стають чужорідними агентами для організму. Відповідно, з появою в організмі антигенів розвивається комплекс реакцій імунної відповіді, спрямованих на їх знищення. Поступово відбувається заміщення загиблих м'язових клітин на сполучну тканину, яка не має здатності до розтяжності та скоротливості, властивої міокарду. Внаслідок втрати основних функцій міокарда серце втрачає здатність функціонувати як насос. У відповідь на це (як компенсаторна реакція) камери серця розширюються (тобто відбувається їх дилатація), а в частині міокарда, що залишилася, відбувається потовщення і ущільнення (тобто розвивається його гіпертрофія). Для збільшення доставки кисню органам та тканинам організму виникає стійке почастішання серцевого ритму (синусова тахікардія). Ця компенсаторна реакція лише на якийсь час покращує насосну функцію серця. Однак можливості дилатації та гіпертрофії міокарда обмежуються кількістю життєздатного міокарда та є індивідуальними для кожного конкретного випадку захворювання. При переході процесу на стадію декомпенсації розвивається хронічна серцева недостатність. Однак на цьому етапі набуває чинності ще один компенсаторний механізм: тканини організму збільшують екстракцію кисню з крові порівняно зі здоровим організмом. Але цей механізм недостатній, оскільки зниження насосної функції серця веде до зменшення надходження до органів і тканин кисню, який є необхідним для нормальної життєдіяльності, при цьому кількість вуглекислого газу в них збільшується. У 2/3 хворих на порожнинах шлуночків на пізніх стадіях хвороби утворюються пристінкові тромби (внаслідок зниження насосної функції серця, а також при нерівномірності скорочення міокарда в камерах серця) з подальшим розвитком емболії малого або великого кола кровообігу. Патогістологічні та патоморфологічні зміни в серці. Форма серця стає кулястою, маса його збільшується від 500 до 1000 г, переважно за рахунок лівого шлуночка. Міокард стає в'ялим, тьмяним, з помітними білуватими прошарками сполучної тканини, є характерне чергування гіпертрофованих та атрофічних кардіоміоцитів. Мікроскопічно виявляється дифузний фіброз, він може поєднуватись як з атрофією, так і з гіпертрофією кардіоміоцитів, у яких відзначаються значне збільшення об'єму ядер, кількості мітохондрій, гіперплазія апарату Гольджі, збільшення кількості міофібрил, вільних та пов'язаних з ендоплазматичним ретикулумом риб. 8. Клінічна картина та діагностика дилатаційної кардіоміопатії (ДКМП) Специфічних ознак захворювання немає. Клінічна картина поліморфна і визначається: 1) симптомами серцевої недостатності; 2) порушеннями ритму та провідності; 3) тромбоемболічний синдром. Найчастіше прогноз захворювання визначається поразкою лівого шлуночка серця. До серцевої недостатності ДКМП протікає латентно. Найбільш частими скаргами серцевої недостатності, що вже настала, є скарги на зниження працездатності, підвищену стомлюваність, задишку при фізичному навантаженні, а потім у спокої. Ночами турбує сухий кашель (еквівалент серцевої астми), пізніше – типові напади ядухи. У хворих спостерігаються характерні ангінозні болі. При розвитку застійних явищ у великому колі кровообігу з'являються тяжкість у правому підребер'ї (внаслідок збільшення печінки), набряки ніг. Діагностика При діагностиці захворювання важливою ознакою є значне збільшення серця (ознаки клапанної вади серця чи артеріальної гіпертензії відсутні). Кардіомегалія проявляється розширенням серця в обидві сторони, що визначається перкуторно, а також зміщенням верхівкового поштовху вліво та вниз. У тяжких випадках вислуховуються ритм галопу, тахікардія, шуми відносної недостатності мітрального або тристулкового клапанів. У 20% випадків розвивається мерехтіння передсердь. Артеріальний тиск зазвичай нормальний або трохи підвищений (внаслідок серцевої недостатності). Біохімічні дослідження крові та сечі дозволяють виявити різні токсичні речовини, а також дефіцит вітамінів. Інструментальні методи дослідження дозволяють виявити: 1) ознаки кардіомегалії; 2) зміни показників центральної гемодинаміки; 3) порушення ритму та провідності. Фонокардіограма підтверджує аускультативні дані у вигляді ритму галопу досить частого виявлення систолічного шуму. Рентгенологічно виявляються значне збільшення шлуночків та застій крові у легеневому (малому) колі кровообігу. ЕхоКГ допомагає виявити дилатацію обох шлуночків, гіпокінезію задньої стінки лівого шлуночка, парадоксальний рух міжшлуночкової перегородки під час систоли. Радіоізотопне дослідження серця (сцинтиграфія міокарда) проводиться для уточнення стану насосної функції серця, а також визначення зон загиблого міокарда. Ангіокардіографічно виявляються самі зміни, як і на ехокардіограмі. Прижиттєва біопсія міокарда неінформативна визначення етіології кардіоміопатії. У деяких випадках у біоптаті можна виявити вірусний антиген або збільшення вмісту ЛДГ, а також погіршення енергопродукції мітохондріями. 9. Диференціальна/діагностика дилатаційної кардіоміопатії (ДКМП) Виробляється в першу чергу з міокардитом та міокардіодистрофіями, тобто з тими станами, які іноді необґрунтовано називаються вторинними кардіоміопатіями. Біопсія міокарда надає суттєву допомогу при диференціальній діагностиці дилатаційної кардіоміопатії та захворювань серця, що протікають із вираженим його збільшенням: 1) при тяжких дифузних міокардитах виявляється клітинна інфільтрація строми у поєднанні з дистрофічними та некротичними змінами кардіоміоцитів; 2) при первинному амілоїдозі, що протікає з ураженням серця (так званий кардіопатичний варіант первинного амілоїдозу), спостерігається значне відкладення амілоїду в інтерстиціальній тканині міокарда, що поєднується з атрофією м'язових волокон; 3) при гемохроматозі (захворюванні, зумовленому порушенням обміну заліза) у міокарді знаходять відкладення залізовмісного пігменту, спостерігаються різного ступеня дистрофія та атрофія м'язових волокон, розростання сполучної тканини. Як варіант ДКМП можна розглянути медикаментозні та токсичні кардіоміопатії. Численні агенти можуть викликати токсичні пошкодження міокарда: етанол, еметин, літій, кадмій, кобальт, миш'як, ізпротеренол та інші отрути. Патогістологічні зміни у тканинах серцевого м'яза проявляються у вигляді осередкових дистрофій. Найяскравішим прикладом токсичної кардіоміопатії є кардіоміопатія, яка спостерігається у людей, які надмірно споживають пиво. У гострій стадії перебігу кобальтової кардіоміопатії відзначаються наявність гідропічної та жирової дистрофії, деструкція внутрішньоклітинних органел, осередковий некроз кардіоміоцитів. Алкогольна кардіоміопатія. Етанол надає прямий токсичний вплив на кардіоміоцити. Макроскопічно міокард в'ялий, глинистого вигляду, іноді спостерігаються маленькі рубчики. Коронарні артерії інтактні. При мікроскопічному дослідженні відзначається поєднання дистрофії (гідропічної та жирової), атрофії та гіпертрофії кардіоміоцитів, можлива наявність вогнищ лізису кардіоміоцитів та склерозу. Уражені ділянки міокарда контрастують із незміненими. При електронно-мікроскопічному дослідженні біоптатів серця спостерігається кістозне розширення саркоплазматичної мережі та Т-системи кардіоміоцитів, що є характерним для алкогольної кардіоміопатії. Ускладнення алкогольної кардіоміопатії – раптова смерть внаслідок фібриляції шлуночків або хронічна серцева недостатність, тромбоемболічний синдром. 10. Лікування та профілактика дилатаційної кардіоміопатії (ДКМП) Загальні принципи лікування ДКМП немає значних відмінностей від лікування хронічної серцевої недостатності. У випадках вторинної ДКМП додатково проводиться лікування попереднього захворювання (пороку клапана серця і т. д.), а також вживаються всі заходи для усунення причин виникнення ДКМП. Досить ефективними є периферичні вазодилататори, особливо при супутньому ангінозному синдромі (нітронг, сустак, нітросорбід). При ангінозному синдромі виникає необхідність застосовувати антиангінальні препарати, переважно пролонговані нітрати (сустак, нітронг, нітросорбід). Ефективними є адреноблокатори (їх призначають за відсутності ознак серцевої недостатності). Із сучасних методів хірургічного лікування ДКМП найефективнішим є пересадка (трансплантація) серця. Однак можливості проведення цієї операції суттєво обмежені. З цієї причини як альтернатива пересадці серця при сучасному лікуванні для збільшення тривалості життя хворим на ДКМП розроблені та проводяться реконструктивні операції, які спрямовані на ліквідацію недостатності мітрального та трикуспідального клапанів серця. Альтернатива пересадці серця у хворих на ДКМП - часткове видалення лівого шлуночка з метою зменшення його розмірів (операція Батиста). Нещодавно для лікування хворих на ДКМП були розроблені спеціальні моделі електрокардіостимуляторів, вони дозволяють зробити роботу шлуночків серця синхронною. Це призводить до покращення наповнення шлуночків серця кров'ю та збільшення насосної функції серця. ДКМП у дітей становить 5-10 випадків на 100 000 дитячого населення на рік. Найбільший ефект лікування дилатаційної кардіоміопатії у дітей раннього віку досягається за допомогою комбінації кортикостероїдів та глікозидів (преднізолону та дигоксину). На тлі монотерапії преднізолон відбувається зменшення частоти серцевих скорочень. Монотерапія дигоксином призводить до зменшення тахікардії та задишки. Враховуючи недоцільність призначення цитостатичних препаратів у дітей раннього віку, оскільки спостерігалася значна кількість ускладнень лікування, найбільш оптимальним у педіатрії є використання при дилатаційній кардіоміопатії серцевих глікозидів пролонгованої дії у поєднанні з кортикостероїдними гормонами. Профілактика. Профілактика ДКМП полягає у виключенні алкоголю, кокаїну, а також проведенні ретельного контролю показників серцевої діяльності при хіміотерапії пухлин. Корисно проводити загартовування організму з раннього віку. Повна відмова від вживання алкоголю при алкогольному різновиді ДКМП сприяє покращенню скорочувальної функції серця та може усунути необхідність його пересадки. 11. Класифікація кардіоміопатії. Етіологія гіпертрофічної кардіоміопатії (ГКМП) Гіпертрофічна кардіоміопатія (ГКМП) - це некоронарогенне захворювання міокарда шлуночків (переважно лівого), що характеризується масивною гіпертрофією їх стінок з випинанням в порожнину правого шлуночка міжшлуночкової перегородки (МЖП), яка може бути значно потовщена. та порушенням розслаблення (діастолічною дисфункцією). Найчастіше зустрічається ізольована гіпертрофія міжшлуночкової перегородки (ізольований гіпертрофічний субаортальний стеноз – ІГСС) або апікальної частини шлуночків. Класифікація. Класифікація ГКМП з локалізації гіпертрофії (ED Wigle et al., 1985 з доповненнями). I. Гіпертрофія ЛШ. 1. Асиметрична гіпертрофія, при якій відбувається гіпертрофія міокарда окремих стінок або сегментів шлуночків (у тому числі гіпертрофія МЖП – 90 % з обструкцією вихідного тракту лівого шлуночка або без неї, середньошлуночкова – 1 %, апікальна гіпертрофія лівого шлуночка – 3 %, гіпертрофія вільної лівого шлуночка та задньої частини МЖП - 1%). 2. Симетрична (концентрична) гіпертрофія лівого шлуночка, коли гіпертрофія міокарда поширюється на всі стінки шлуночків, трапляється у 5 % випадків. ІІ. Гіпертрофія ПЗ. У тому випадку, коли гіпертрофія міокарда перешкоджає нормальному відтоку крові із шлуночків серця, говорять про обструктивну форму ГКМП. В інших випадках ГКМП є необструктивною. Етіологія. Захворювання може бути як уродженим, так і набутим. Вроджена ГКМП успадковується за аутосомно-домінантним типом. У межах однієї і тієї ж сім'ї можуть спостерігатися різні форми та варіанти ГКМП. Найчастіше успадковується асиметрична гіпертрофія міжшлуночкової перегородки. Набута форма ГКМП зустрічається у хворих похилого віку з артеріальною гіпертонією в анамнезі. Поширеність – 0,02-0,05 %. Причин розвитку набутих ДКМП до кінця не вивчені. Згідно з однією із запропонованих гіпотез у осіб із набутою ГКМП у внутрішньоутробному періоді відбувається формування дефекту адренергічних рецепторів серця, що беруть участь у регуляції серцевої діяльності, зокрема частоти серцевих скорочень. В результаті значно підвищується чутливість до норадреналіну та аналогічним йому гормонам, що збільшує частоту серцевих скорочень, що впливає на розвиток у них гіпертрофії міокарда, а згодом – і ГКМП. Патогістологічна картина. Дезорієнтоване, неправильне, хаотичне розташування кардіоміоцитів та міофібрил у кардіоміоцитах, фіброз міокарда – порушення архітектоніки серцевого м'яза. 12. Клінічна картина та діагностика гіпертрофічної кардіоміопатії (ГКМП) Клінічна картина. Для ГКМП характерна надзвичайна різноманітність симптомів, що є причиною помилкової діагностики. Наявність та строки появи скарг при ГКМП в основному визначаються 2 факторами: формою ГКМП та локалізацією ураження. Найпотужнішою камерою серця є лівий шлуночок, тому при гіпертрофії міокарда його стінок скарги можуть не виявлятися тривалий час. Ізольована поразка правого шлуночка серця зустрічається вкрай рідко. Клінічну картину ГКМП становлять: 1) ознаки гіпертрофії міокарда шлуночків (переважно лівого); 2) ознака недостатньої діастолічної функції шлуночків; 3) варіабельні ознаки обструкцій вихідного тракту лівого желудочка. Діагностика У процесі діагностичного пошуку найбільш істотним є виявлення шуму систоли, зміненого пульсу і зміщеного верхівкового поштовху. Для діагностики ГКМП найбільше значення мають дані ехокардіографії, що дозволяють уточнити анатомічні особливості захворювання, ступінь гіпертрофії міокарда, обструкцію вивідного тракту лівого шлуночка. Виявляються такі ознаки: асиметрична гіпертрофія МЖП, більш виражена у верхній третині, її гіпокінез; систолічний рух передньої стулки мітрального клапана у напрямку допереду; зіткнення передньої стулки мітрального клапана з МЖП діастолу. Неспецифічними ознаками є гіпертрофія лівого передсердя, гіпертрофія задньої стінки лівого шлуночка, зменшення середньої швидкості діастолічного прикриття передньої стулки мітрального клапана. На ЕКГ будь-які специфічні зміни виявляються лише за досить розвиненої гіпертрофії лівого желудочка. Рентгенодіагностика має значення лише в розвиненій стадії хвороби, коли можуть визначатися збільшення лівого шлуночка і лівого передсердя, розширення частини аорти, що сходить. На фонокардіограмі амплітуди І та ІІ тонів збережені, що є диференціальною ознакою ГКМП від стенозу гирла аорти, а також виявляється систолічний шум різного ступеня вираженості. Інвазивні методи дослідження (зондування лівих відділів серця, контрастна ангіографія) нині є обов'язковими, оскільки ехокардіографія дає цілком достовірну для встановлення діагнозу інформацію. Застосовується зондування серця під рентгенотелевізійним контролем. Техніка виконання методу: шляхом пункції великої артерії під місцевою анестезією з подальшим введенням спеціального катетера в порожнину серця вимірюють градієнт (різницю) тиску між лівим шлуночком і аортою, що відходить від нього. У нормі цього градієнта не повинно бути. 13. Лікування та профілактика гіпертрофічної кардіоміопатії (ГКМП) Лікування. В основі медикаментозного лікування ГКМП лежать лікарські засоби, що покращують кровонаповнення шлуночків серця у діастолу. Цими препаратами є група b-адреноблокаторів (анаприлін, атенолол, метопролол та пропранолол, 160-320 мг/добу та ін.) та група антагоністів іонів кальцію (верапаміл, але з обережністю). Новокінаміді дизопірамід також зменшують частоту серцевих скорочень та мають протиаритмічний ефект. На самому початку лікування застосовують малі дози цих препаратів, потім відбувається поступове збільшення дозування до хворим, що максимально переноситься. b-адреноблокатори застосовують з обережністю при цукровому діабеті, бронхіальній астмі та деяких інших захворюваннях. При лікуванні цими препаратами потрібен постійний контроль рівня артеріального тиску та частоти пульсу. Небезпечним є зниження тиску нижче 90/60 мм рт. ст. та частоти пульсу нижче 55 за хвилину. Якщо у хворого виявляються небезпечні порушення ритму, які не піддаються лікуванню b-адреноблокаторами або антагоністами іонів кальцію, то при лікуванні хворих додатково використовуються інші антиаритмічні препарати. Призначення антикоагулянтів рекомендується при пароксизмальних аритміях та миготливих артіміях, а також за наявності тромбів у камерах серця (варфарин та ін.). У період лікування цими препаратами необхідно регулярно проводити контроль ряду показників системи згортання крові. При значному передозуванні антикоагулянтів можливі зовнішні (носові, маткові та ін.) та внутрішні кровотечі (гематоми та ін.). Хірургічне лікування проводиться хворим з обструктивною формою ГКМП у тому випадку, коли медикаментозне лікування не є ефективним або при рівні градієнта між лівим шлуночком та аортою понад 30 мм рт. ст. (Здійснюється операція міотомії або міоектомії - висічення або видалення частини гіпертрофованого міокарда лівого шлуночка). Також проводять протезування мітрального клапана та нехірургічну абляцію МЖП. Профілактика. Всім хворим на ГКМП, особливо з обструктивною формою, протипоказані заняття такими видами спорту, при яких можливе виражене збільшення фізичного навантаження за невеликий проміжок часу (легка атлетика, футбол, хокей). Профілактика захворювання полягає в ранній діагностиці, що дає можливість розпочати раннє лікування хвороби та запобігти розвитку вираженої гіпертрофії міокарда. Обов'язкове виконання ЕхоКГ у генетичних родичів хворого. Важливі для діагностики та скринінгові ЕКГ та ЕхоКГ, які проводяться при щорічній диспансеризації. У пацієнтів з обструктивною формою ГКМП необхідно проводити профілактику інфекційного ендокардиту (антибіотикопрофілактика тощо), оскільки наявність обструкції створює умови для розвитку цього загрозливого стану. 14. Причини виникнення рестриктивної кардіоміопатії (РКМП) Рестриктивна кардіоміопатія (РКМП) - (від лат. слова restrictio - "обмеження") - група захворювань міокарда та ендокарда, при яких внаслідок різко вираженого фіброзу та втрати еластичності, зумовленими різними причинами, відбувається фіксоване обмеження заповнення шлуночків у діастолу. До РКМП належать: лефлерівський парієтальний фібропластичний ендокардит (зустрічається в країнах з помірним кліматом, описаний W. Loffler та ін., 1936) і ендоміокардіальний фіброз (зустрічається в країнах тропічної Африки, описаний D. Bedford et E. Konstman). Причини виникнення РКМП. Первинна РКМП зустрічається дуже рідко, і єдиною доведеною причиною її виникнення є так званий гіпереозинофільний синдром (хвороба Леффлера, лефлерівський парієтальний фібропластичний ендокардит). Зустрічається переважно у чоловіків віком 30-40 років. При гіпереозинофільному синдромі відбувається запалення ендокарда, що згодом завершується значним ущільненням ендокарда і грубим його спаянням з розташованим поруч міокардом, що веде до різкого зниження розтяжності серцевого м'яза. Для лефлерівського синдрому також характерні персистуюча протягом 6 місяців і більше еозинофілія (1500 еозинофілів в 1 мм3), ураження внутрішніх органів (печінки, нирок, легенів, кісткового мозку). У переважній більшості випадків походження РКМП є вторинним, зумовленим іншими причинами, серед яких найчастішими є: 1) амілоїдоз – захворювання, пов'язане з порушенням білкового обміну в організмі; при цьому в тканинах різних органів утворюється та відкладається у великій кількості аномальний білок (амілоїд); при ураженні серця амілоїд викликає зниження його скоротливості та розтяжності; 2) гемохроматоз - порушення обміну заліза в організмі, що супроводжується підвищеним вмістом заліза в крові, його надлишок відкладається в багатьох органах і тканинах, у тому числі і в міокарді, викликаючи цим зниження його розтяжності; 3) саркоїдоз - захворювання невідомої етіології, що характеризується утворенням в органах і тканинах клітинних скупчень (гранулем); найчастіше уражаються легені, печінка, лімфовузли та селезінка; а гранульоми, що розвиваються, в міокарді призводять до зниження його розтяжності; 4) захворювання ендокарда (ендокардіальний фіброз, фіброеластоз ендокарда та ін), коли спостерігається значне потовщення та ущільнення ендокарда, що також призводить до різкого обмеження розтяжності міокарда. Фіброеластоз ендокарда, зокрема, може зустрічатися лише у немовлят; ця хвороба не є сумісною із життям через ранній розвиток вираженої серцевої недостатності. 15. Клінічна картина та діагностика рестриктивної кардіоміопатії (РКМП) Клінічна картина. Прояви хвороби надзвичайно поліморфні та визначаються симптомами порушення кровообігу у малому чи великому колі (залежно від переважного ураження правого чи лівого шлуночків). Скарги можуть бути відсутніми або обумовлені застійними явищами в малому або великому колі кровообігу. Хворі зазвичай скаржаться на задишку, яка спочатку з'являється при фізичному навантаженні, а з розвитком захворювання задишка спостерігається і в спокої. Через зниження насосної функції серця хворий скаржиться на швидку стомлюваність та погану переносимість будь-якого навантаження. Згодом приєднуються набряки ніг, збільшення печінки та водянка живота. Періодично з'являється неритмічне серцебиття, а при розвитку стійких блокад можуть бути непритомні стани. Перша стадія розвитку захворювання (некротична) характеризується появою лихоманки, втратою ваги, кашлем, висипанням шкіри та тахікардією. Діагностика Розпізнавання РКМП дуже важко. З упевненістю про цю патологію можна говорити тільки після виключення низки схожих захворювань (таких як ідіопатичний міокардит типу Абрамова-Фідлера, ексудативний перикардит, клапанні вади серця). При огляді хворих на РКМП виявляються характерні для застійної серцевої недостатності симптоми (набряки, гепатомегалія та асцит), а також виражена пульсація вен шиї. При аускультації велике значення набуває виявлення збільшення серця, м'якого пізнього шуму систоли і гучного раннього III тону. При ЕКГ-дослідженні виявляються помірна гіпертрофія міокарда шлуночків, а також різні порушення ритму та провідності серцевого імпульсу, неспецифічні зміни зубця Т на ЕКГ. ЕхоКГ-дослідження є одним із найбільш інформативних методів діагностики захворювання, з його допомогою виявляються потовщення ендокарда, зміна характеру наповнення шлуночків серця, зниження насосної функції серця, швидкий рух передньої стулки мітрального клапана в період діастоли та швидкий ранній рух задньої стінки лівого шлуночка назовні. Магніторезонансна томографія дозволяє отримати інформацію про анатомію серця, визначити патологічні включення до міокарда та виміряти товщину ендокарда. При дослідженні параметрів центральної гемодинаміки визначається підвищений тиск заповнення в обох шлуночках, причому кінцевий тиск у лівому перевищує аналогічний показник у правому шлуночку. Вентрикулографія виявляє посилення скорочення лівого шлуночка, гладкі контури його стінок, іноді з дефектом заповнення області верхівки (свідчення облітерації). Спостерігаються ознаки клапанної недостатності, зокрема мітрального чи тристулкового клапана. 16. Диференціальна діагностика, лікування та профілактика рестриктивної кардіоміопатії (РКМП) Диференційна діагностика. При диференціальній діагностиці РКМП дуже важливо враховувати схожість захворювання на зовнішні прояви з констриктивним перикардитом, але методика лікування при цих захворюваннях діаметрально протилежна. Прижиттєва біопсія міокарда і ендокарда зазвичай застосовується одночасно із зондуванням серця, що дозволяє мати більшу інформативність для уточнення природи захворювання і проведення подальшого лікування. У вкрай поодиноких випадках, коли перераховані вище методи діагностики не дозволяють відрізнити РКМП від констриктивного перикардиту, проводять безпосередню ревізію перикарда на операційному столі. Всім хворим на РКМП необхідно проведення всебічного клініко-біохімічного та додаткового обстеження для визначення позасерцевих причин захворювання. Лікування. Лікування захворювання становить значні труднощі. Більшість лікарських засобів, які використовуються для лікування серцевої недостатності, можуть не приносити бажаних результатів у зв'язку з тим, що внаслідок особливостей захворювання неможливо отримати значне покращення розтяжності міокарда (у деяких випадках для цього призначають антагоністи іонів кальцію). Використовуються сечогінні препарати (альдактон) для усунення надлишку рідини в організмі. Для ліквідації стійких порушень провідності може виникнути потреба у постановці (імплантації) постійного електрокардіостимулятора. До цього призводять такі захворювання, як саркоїдоз та гемохроматоз, що призводять до розвитку вторинних РКМП, вони підлягають самостійному лікуванню. При лікуванні саркоїдозу використовують гормональні препарати (преднізолон та ін), а при гемохроматозі – регулярні кровопускання (для зниження концентрації заліза в організмі). Лікування амілоїдозу міокарда має пряму залежність від причин виникнення. Доцільним є застосування антикоагулянтних препаратів при тромбоутворенні в камерах серця. До хірургічного лікування вдаються у випадках РКМП, спричинених ураженням ендокарда. У ході операції по можливості січуть частину ендокарда, що зазнала змін. У деяких випадках, якщо є недостатність передсердно-шлуночкових клапанів, відбувається їх протезування. Лікування деяких форм амілоїдного ураження міокарда здійснюється за допомогою пересадки серця. Профілактика РКМП. На жаль, профілактичні заходи при цьому захворюванні обмежені. Головним чином необхідно раннє виявлення потенційно усунутих причин амілоїдозу, саркоїдозу, гемохроматозу та ін. Для досягнення цих цілей велике значення має проведення щорічної диспансеризації населення. 17. Етіологія інфекційного ендокардиту (ІЕ) Інфекційний ендокардит (ІЕ) - захворювання, що полягає у поліпозно-виразковому ураженні клапанного апарату серця (нерідко з розвитком клапанної недостатності) або пристінкового ендокарда (рідше уражається ендотелій аорти або найближчої великої артерії). Викликається захворювання на різні патогенні мікроорганізми і супроводжується системним ураженням внутрішніх органів (нирок, печінки, селезінки) на тлі зміненої реактивності організму. Етіологія. Патогенними збудниками хвороби найчастіше є кокова група мікроорганізмів - стрептококи (зелений стрептококи раніше виділялися в 90% випадків), стафілококи (золотистий, білий), ентерокок, пневмокок. В останні роки у зв'язку з широким використанням антибіотиків спектр мікробних збудників став іншим. Хворобу може викликати грамнегативна флора (кишкова паличка, синьогнійна паличка, протей, клебсієла), з'явилися дані про важливу роль патогенних грибів, сарцин, бруцел і вірусів. Захворювання, спричинені цими збудниками, протікають важче, особливо ендокардит, спричинений грибковою інфекцією (виникає, як правило, у зв'язку з нераціональним прийомом антибіотиків). Однак у ряду хворих справжній збудник захворювання не виявляється (частота негативного результату посіву крові 20-50%). Часто інфекція виникає на місці протезованого клапана - так званий протезний ІЕ, що розвивається переважно протягом 2 місяців після оперативного втручання з протезування клапана серця. У цьому випадку збудник захворювання найчастіше має стрептококову природу. Таким чином, джерела інфекції та бактеріємії при ІЕ найрізноманітніші (операції в порожнині рота, операції та діагностичні процедури в сечостатевій сфері, оперативне втручання на серцево-судинну систему (у тому числі протезування клапанів), тривале перебування катетера у вені, часті внутрішньовенні вливання та ендоскопічні методи. дослідження, хронічний гемодіаліз (артеріовенозний шунт), внутрішньовенне введення наркотиків). Виділяють так званий первинний ІЕ, що розвинувся на інтактних клапанах, а також ІЕ на тлі вроджених та набутих змін серця та його клапанного апарату – вторинний ендокардит. Ці зміни і дозволяють виділяти пацієнтів в окремі групи ризику: вади серця (вроджені та набуті), пролапс мітрального клапана, артеріовенозні аневризми, постінфарктні аневризми, шунти, стан після операції на серці та великих судинах. 18. Патогенез та класифікація інфекційного ендокардиту (ІЕ) Патогенез. Механізм розвитку ІЕ складний та вивчений недостатньо. У розвитку захворювання можна назвати 3 стадії. І стадія (інфекційно-токсична) протікає з різним ступенем виразності інтоксикації. Відбувається зростання бактерій, руйнування клапанів, що веде до розвитку вад серця; у цій же стадії часто відбувається генералізація процесу за рахунок гематогенного поширення інфекції - від клапана можуть відокремлюватися шматочки стулок або колоній мікроорганізмів, стулки можуть розриватися. ІІ стадія – імунозапальна, при якій фіксовані на клапанах мікроорганізми викликають тривалу аутосенсибілізацію та гіперергічне пошкодження органів та тканин організму (імуна генералізація процесу). III стадія – дистрофічна – виникає при прогресуванні патологічного процесу: функції низки органів порушуються, виникає серцева та ниркова недостатність, що ще більше посилює перебіг захворювання (див. табл.). Таблиця Класифікація ІЕ
Також розрізняють активний та неактивний (загоюваний) ІЕ. Існує і хірургічна класифікація, у якій виділяють: 1) ураження обмежується стулками клапана; 2) ураження поширюється межі клапана. Гострий ІЕ (швидкопрогресуючий, розвивається протягом 8-10 тижнів) зустрічається рідко, як правило, у осіб, які раніше не мали поразки серця, і клінічно проявляється картиною загального сепсису. Підгострий ІЕ (зустрічається найчастіше) триває 3-4 місяці, при адекватній медикаментозній терапії може настати ремісія. Затяжний ІЕ триває багато місяців із періодами загострення та ремісій, йому характерні неяскраві клінічні прояви. При несприятливому перебігу виникають важкі ускладнення, і хворі гинуть від серцевої недостатності, що прогресує, наростає септичної інтоксикації. 19. Клінічна картина та діагностика інфекційного ендокардиту (ІЕ) Клінічна картина. Прояви ІЕ представлені як синдромів. 1. Синдром запальних змін та септицемії. 2. Синдром загальної інтоксикації організму. 3. Синдром ураження клапанів. 4. Синдром “лабораторних” імунних порушень. 5. Синдром тромбоемболічних ускладнень. 6. Синдром генералізації поразок. Діагностика ІЕ заснована насамперед на ранньому виявленні збудника захворювання. І тому використовуються такі лабораторно-инструментальные дослідження. 1. Отримання позитивної гемокультури. 2. Проведення НБТ (нітроблуттетразоліум тесту). 3. Клінічний аналіз крові для виявлення острофазових показників: підвищення ШОЕ до 50 мм/год і більше, лейкоцитоз зі зсувом лейкоцитарної формули вліво або (у ІІ стадії) можуть виявлятися лейкопенія та гіпохромна анемія. 4. Виявлення імунологічних зрушень. 5. Аналіз сечі проводиться для уточнення уражень різних органів та систем, коли виявляється гломерулонефрит, що проявляється протеїнурією, циліндрурією та гематурією. 6. Пряма діагностична ознака ІЕ – наявність вегетації на клапанах серця – виявляється при ехокардіографії. Таким чином, із усього різноманіття симптомів слід виділяти основні та додаткові. Основні критерії діагнозу ІЕ: 1) лихоманка з температурою понад 38 ° C з ознобами; 2) плями Лукіна; 3) вузлики Ослера; 4) ендокардит на незмінених клапанах (первинний) або на тлі ревматичних та вроджених вад серця. Інфекційний міокардит; 5) множинні артеріальні тромбоемболії, розриви мікотичних аневризм із крововиливами; 6) спленомегалія; 7) позитивна гемокультура; 8) виражений позитивний ефект застосування антибіотиків. Додаткові критерії діагнозу ІЕ: 1) підвищення температури тіла до 38 ° C, познабування; 2) геморагії на шкірі; 3) швидке схуднення; 4) асиметричний артрит дрібних суглобів кистей рук, стоп; 5) анемізація; 6) ШОЕ понад 40 мм/год; 7) різко позитивний СРВ; 8) наявність ревматоїдного фактора; 9) a-глобуліни вище 25%; 10) підвищення вмісту імуноглобулінів М, Е та А. 20. Лікування та профілактика інфекційного ендокардиту (ІЕ) Лікування. Лікування ІЕ має бути якомога більш раннім та етіотропним з урахуванням бактеріологічних даних. Доцільно поєднання консервативного та хірургічного лікування. Для лікування ІЕ у будь-яких вікових групах насамперед використовують антибіотики, які мають бактерицидну дію на мікроорганізми. Препаратом початкового вибору, як і раніше, є пеніцилін. Добова доза - до 20 000 000 ОД вводиться внутрішньовенно та внутрішньом'язово. Однак не слід виключати і той факт, що у хворих похилого та старечого віку під час лікування пеніциліном та іншими антибіотиками у високих дозах часто спостерігається кардіотоксичний ефект. При невідомій етіології лікування починають з високих доз бензилпеніциліну внутрішньом'язово або внутрішньовенно до 18 000 000-20 000 000 ОД і більше, застосовують комбінацію зі стрептоміцином до 1 г внутрішньом'язово на добу або аміноглікозидами (гентаміцин, тобрамі кг на добу). Цефалоспорини також є базисними препаратами, що застосовуються для лікування ІЕ: найбільш часто використовують клафоран, цефамізин (4-6 г/добу, внутрішньом'язово та внутрішньовенно), а також цепорин (4-10 г/добу) та кефзол (до 10-16 г внутрішньовенно). та ін.). Гарною протистафілококовою дією має фузидин, у ряді випадків він ефективний при резистентності мікроорганізмів до інших антибіотиків (8-10 г/добу). Лікування антибіотики призначають тривало курсом 1,5-2 місяці, до того часу, поки інфекція буде повністю ліквідована. При зниженій імунореактивності організму антибактеріальні засоби поєднують з пасивною імунотерапією з використанням імуномодуляторів (тималіна, Т-активіну та ін.). Для профілактики тромбозів, наприклад, при ендокардиті, що розвинувся на тлі ан-гіогенного сепсису, створюється регульована гіпокоагуляція за допомогою гепарину (20 000-25 000 ОД внутрішньовенно або підшкірно). Для інгібіції протеолітичних ферментів використовують контрикал (до 40-000 ОД внутрішньовенно краплинно). Коли клапанний ІЕ сприяв формуванню вади клапана серця або прояви захворювання не зникають, незважаючи на масивну антибактеріальну терапію, доцільно проводити хірургічне лікування. Головна мета операції – збереження власного клапана хворого. Іноді обмежуються видаленням вегетацій, ушиванням розривів стулок і т. д. Якщо клапан практично повністю руйнується під впливом інфекції, його замінюють штучним (протезують) за допомогою механічних та біологічних протезів. Профілактика. Профілактика ІЕ полягає у своєчасній санації хронічних вогнищ інфекції в порожнині рота, мигдаликах, носоглотці, придаткових пазухах носа, застосуванні активної антибактеріальної терапії при гострих стрептококових та стафілококових захворюваннях (ангінах та ін.). Рекомендується загартовування організму. 21. Етіологія бронхіальної астми (БА) Вичерпного визначення бронхіальної астми не існує до теперішнього часу, проте найбільш повне визначення даного захворювання було дано Федосєєвим Г Б. в 1982 р. Бронхіальна астма (БА) - самостійне, хронічне, рецидивне захворювання з переважним ураженням дихальних шляхів, основним і обов'язковим патогенетичним механізмом змінена реактивність бронхів, обумовлена специфічними (імунологічними) та (або) неспецифічними, вродженими або набутими механізмами, а основною (обов'язковою) клінічною ознакою - напад задухи та (або) астматичний стан (астматичний статус) внаслідок спазму гладких м'язів бронхів, гіперсекреції, дискринії та набряку слизової оболонки бронхів. Етіологія. У виникненні бронхіальної астми важливу роль відіграє поєднання ряду факторів. У зв'язку з цим розрізняють 2 форми бронхіальної астми - атопічну (від лат. athopia - "спадкова схильність") і інфекційно-алергічну. Спадкова схильність обумовлена зв'язком деяких антигенів гістосумісності (НБА) з тяжкістю перебігу бронхіальної астми, а наростання тяжкості захворювання особливо часто відзначається у носіїв антигенів В35 і В40. Внутрішні фактори розвитку хвороби - це біологічні дефекти імунної, ендокринної систем, вегетативної нервової системи, чутливості та реактивності бронхів, мукоциліарного кліренсу, ендотелію судин легень, системи швидкого реагування (огрядні клітини та ін), метаболізму арахідон. Зовнішні фактори включають: 1) інфекційні алергени (віруси, бактерії, гриби, дріжджі тощо); 2) неінфекційні алергени (пилкові, пилові, виробничі, лікарські, харчові; алергени кліщів, комах та тварин); 3) механічні та хімічні подразники (металевий, деревний, силікатний, бавовняний пил; пари кислот, лугів; дими тощо); 4) метеорологічні та фізико-хімічні фактори (зміна температури та вологості повітря, коливання барометричного тиску, магнітного поля Землі, фізичні зусилля тощо); 5) стресові, нервово-психічні впливи та фізичне навантаження. Інфекційні агенти можуть чинити не тільки алергізуючу дію, але й знижувати поріг чутливості організму до неінфекційних (атопічних) алергенів, підвищувати проникність для них слизової оболонки органів дихання; формувати зміну реактивності клітин-мішеней (огрядних клітин, базофілів, моноцитів та ін.) та ефекторних систем. 22. Патогенез бронхіальної астми (БА) Патогенез. Змінена реактивність бронхів є центральною ланкою патогенезу захворювання і може бути первинною та вторинною. У першому випадку зміна реактивності буває вродженою та набутою. Вторинні зміни реактивності бронхів – це прояв змін реактивності імунної, ендокринної, нервової систем організму. Таким чином, говорячи про патогенез БА, можна виділити 2 групи механізмів: імунологічні та неімунологічні. Тип I (атопічний, реагіновий або анафілактичний). У відповідь на потрапляння в організм антигенів екзоалергенів (пилки рослин, тварин і рослинних білків, бактерій та лікарських препаратів) відбувається підвищена вироблення (реагінів), які фіксуються та накопичуються на опасистих клітинах (первинних клітинах-ефекторах). Це імунологічна стадія бронхіальної астми. Після цього розвивається патохімічна стадія процесу - дегрануляція опасистих клітин із вивільненням вазоактивних, бронхоспастических і хемотаксических речовин (гістаміну, серотоніну, різних хемотаксических чинників та інших.). Під впливом біологічно активних речовин настає патофізіологічна стадія патогенезу: підвищується проникність мікроциркуляторного русла, що веде до розвитку набряку, серозного запалення, бронхоспазму. Реакція III типу (імунокомплексний тип, або феномен Артюса) розвивається під впливом екзоалергенів та ендоалергенів. Реакція відбувається в зоні надлишку антигену за участю преципітуючих антитіл, що належать до імуноглобулінів класів Про та М. Пошкоджуюча дія утвореного комплексу антиген - антитіло реалізується через активацію комплементу, звільнення лізосомних ферментів. Відбуваються ушкодження базальних мембран, спазм гладких м'язів бронхів, розширення судин, підвищується проникність мікроциркуляторного русла. Тип IV (клітинний, гіперчутливість уповільненого типу) характеризується тим, що дія, що пошкоджує, мають сенсибілізовані лімфоцити. У цьому випадку медіаторами алергічної реакції є лімфокіни (діють макрофаги, епітеліальні клітини), лізосомні ферменти, а також активована кінінова система. Під впливом цих речовин відбуваються розвиток набряку, набухання слизової оболонки, бронхоспазм, гіперпродукція в'язкого бронхіального секрету. Неімунологіческіе механізми - це первинна зміна реактивності бронхів в результаті вроджених та набутих біологічних дефектів. Неімунологіческіе механізми діють на первинні або вторинні клітини-ефектори або на рецептори гладких м'язів бронхів, судин, клітин бронхіальних залоз. При цьому змінюється реактивність клітин-мішеней і насамперед опасистих клітин, що супроводжується надмірною продукцією біологічно активних речовин (гістаміну, лейкотрієнів та ін.). Останнім часом говорять про особливу роль у патогенезі порушень бронхіальної прохідності глюкокортикоїдної недостатності та дизоваріальних розладів. Недостатність глюкокортикостероїдів призводить до розвитку гіперреактивності опасистих клітин, зниження синтезу катехоламінів, активації простагландинів F2a, а також порушення імунокомпетентної системи. 23. Класифікація бронхіальної астми (БА) Класифікація. Переважання того чи іншого механізму в патогенезі ТИ БА дозволяє виділити її різні патогенетичні особливості. В даний час використовується класифікація, запропонована Г. Б. Федосєєвим (1982). Етапи розвитку бронхіальної астми. I - передастма (стани, що загрожують розвитком: гострий та хронічний бронхіт, гостра та хронічна пневмонія з елементами бронхоспазму у поєднанні з вазомоторним ринітом, кропив'янкою). II - клінічно оформлена бронхіальна астма (вважається такою після першого нападу або відразу виник астматичного статусу). Форми БА: 1) імунологічна; 2) неімунологічна. Патогенетичні механізми (клініко-патогенетичні варіанти) ХА: 1) атопічний; 2) інфекційнозалежний; 3) аутоімунний; 4) дисгормональний; 5) нервово-психічний дисбаланс; 6) адренергічний дисбаланс; 7) холінергічний дисбаланс; 8) первинно змінена реактивність бронхів. Тяжкість перебігу БА: 1) легке протягом (загострення рідкісні, 2-3 десь у рік, не тривалі напади ядухи купуються прийомом різних бронхолітичних препаратів внутрь); 2) середньої тяжкості (частіші загострення 3-4 рази на рік, напади задухи протікають важче і купіруються ін'єкціями лікарських препаратів); 3) тяжкий перебіг (характеризується частими та тривалими загостреннями, тяжкими нападами, які нерідко переходять в астматичний стан). Фази перебігу БА: 1) загострення (наявність повторно виникаючих нападів бронхіальної астми або астматичного стану); 2) стихающее загострення (приступи стають більш рідкісними і легкими, фізикальні та функціональні ознаки захворювання виражені менше, ніж у фазу загострення); 3) ремісія (зникають типові прояви бронхіальної астми: напади задухи не виникають; повністю або частково відновлюється прохідність бронхів). ускладнення: 1) легеневі: емфізема легень, легенева недостатність, ателектаз, пневмоторакс, астматичний статус та ін; 2) позалегеневі: легеневе серце (компенсоване та декомпенсоване з розвитком правосерцевої недостатності), дистрофія міокарда та ін. 24. Диференційна діагностика бронхіальної астми (БА) Диференційна діагностика. БА диференціюють із серцевою астмою (див. табл. 1). Таблиця 1 Диференційна діагностика БА
25. Лікування та профілактика бронхіальної астми (БА) Лікування. У терапії бронхіальної астми рекомендується ступінчастий підхід, (ступінь 1 - найменша тяжкість перебігу астми, ступінь 4 - найбільша). Ступінь 1. Легкий інтермітуючий перебіг, у разі якого симптоми бронхіальної астми з'являються при експозиції тригера (наприклад, пилку або вовни тварин) або внаслідок фізичного навантаження. Лікування полягає у профілактичному прийомі ліків за необхідності (призначаються інгаляційні – агоністи, кромоглікат, недокроміл або антихолінергічні препарати). Якщо астма проявляється більш частими симптомами, збільшенням потреби у бронходилататорах, виникає необхідність переходу до наступного ступеня. Ступінь 2. Легкий персистуючий перебіг. Первинна терапія включає прийом протизапальних препаратів, інгаляційних кортикостероїдів, кромоглікату натрію або недокромілу натрію. При більш тяжких та тривалих загостреннях призначається короткий курс пероральних кортикостероїдів. Ступінь 3 характеризується середньою тяжкістю перебігу бронхіальної астми. Таким хворим необхідний щоденний прийом профілактичних протизапальних препаратів. Доза інгаляційних кортикостероїдів – 800-2000 мкг у поєднанні з бронходилататорами тривалої дії. Ступінь 4. Тяжкий перебіг бронхіальної астми, коли повністю контролювати її не вдається. У цьому випадку мета лікування – досягнення найкращих можливих результатів. Первинне лікування передбачає призначення інгаляційних кортикостероїдів у високих дозах. Більш тяжке загострення може вимагати проведення курсу лікування пероральними кортикостероїдами, які призначаються у мінімальних дозах або через день. Для запобігання розвитку побічних явищ, високі дози інгаляційних кортикостероїдів вводять через спейсер. Ступінь 5 передбачає зменшення підтримуючої медикації. Це можливо, якщо астма залишається під контролем не менше 3 місяців, що допомагає зменшити ризик побічної дії та підвищує сприйнятливість хворого до запланованого лікування. "Зменшення" лікування проводиться під постійним контролем симптомів, клінічних проявів та показників функцій зовнішнього дихання за допомогою поступового зниження (скасування) останньої дози або додаткових препаратів. Профілактика. Первинна профілактика бронхіальної астми включає лікування хворих у стані передастми, виявлення у практично здорових осіб з обтяженою спадковістю біологічних дефектів, що становлять загрозу виникнення бронхіальної астми, усунення з навколишнього хворих середовища потенційно небезпечних алергенів, ір-ритантів та інших факторів, які можуть призвести до розвитку хвороби. При лікуванні хворих у стані передастми необхідно санувати осередки інфекції, проводити терапію алергічної риносинусопатії, застосовувати різні методи немедикаментозного лікування, включаючи голко- та психотерапію, ЛФК, баротерапію, санаторно-курортне лікування. Показано проведення специфічної та неспецифічної гіпосенсибілізації. 26. Етіологія та патогенез хронічного бронхіту (ХБ) Хронічний обструктивний бронхіт - дифузне неалергічне запальне ураження бронхіального дерева, обумовлене тривалим дратівливим впливом на бронхи різних агентів, що має прогресуючий перебіг і характеризується порушенням легеневої вентиляції по обструктивному типу, слизоутворення і дренуючої функції бронхіального дерева. Хронічний бронхіт поділяється на первинний та вторинний. Первинний ХБ - самостійне захворювання, не пов'язане з іншими бронхолегеневими процесами або ураженням інших органів та систем, при якому спостерігається дифузне ураження бронхіального дерева. Вторинний ХБ розвивається і натомість інших захворювань - як легеневих, і позалегеневих. Етіологія. У розвитку ХБ відіграють роль як екзогенні фактори. Обструктивний синдром розвивається внаслідок поєднання ряду факторів: 1) спазму гладких м'язів бронхів внаслідок дратівливого впливу екзогенних факторів та запальних змін слизової оболонки; 2) гіперсекреції слизу, зміни її реологічних властивостей, що призводять до порушення мукоциліарного транспорту та закупорки бронхів в'язким секретом; 3) метаплазії епітелію з циліндричного в багатошаровий плоский та його гіперплазії; 4) порушення вироблення сурфактанту; 5) запального набряку та інфільтрації слизової оболонки; 6) колапсу дрібних бронхів та облітерації бронхіол; 7) алергічних змін слизової оболонки. Різні співвідношення змін слизової оболонки зумовлюють формування певної клінічної форми: 1) при катаральному необструктивному бронхіті превалюють поверхневі зміни структурно-функціональних властивостей слизової оболонки; 2) при слизово-гнійному (гнійному) бронхіті переважають процеси інфекційного запалення. Однак можлива і ситуація, коли тривалий катаральний бронхіт внаслідок приєднання інфекції може стати слизово-гнійним і т. п. При необструктивному варіанті всіх клінічних форм ХБ вентиляційні порушення виражені незначно; 3) обструктивні порушення спочатку з'являються лише на тлі загострення захворювання та обумовлені запальними змінами бронхів, гіпер- та дискринією, бронхоспазмом (оборотними компонентами обструкції), але потім зберігаються постійно, при цьому обструктивний синдром наростає повільно. 27. Клінічна картина хронічного бронхіту (ХБ) Клінічна картина. Основними симптомами ХБ є кашель, виділення мокротиння, задишка. При загостренні хвороби або внаслідок гіпоксії при розвитку легеневої недостатності та інших ускладнень виявляють симптоми загального характеру (потіливість, слабкість, підвищення температури тіла, стомлюваність тощо). Кашель є типовим проявом хвороби. За його характером та консистенцією мокротиння можна припустити варіант перебігу захворювання. При необструктивному варіанті катарального бронхіту кашель супроводжується виділенням невеликої кількості слизової водянистої мокротиння (частіше вранці, після фізичних вправ або у зв'язку з почастішанням дихання). На початку хвороби кашель не турбує хворого; Поява нападоподібного кашлю вказує на розвиток бронхіальної обструкції. Кашель набуває відтінку гавкаючого і носить пароксизмальний характер при вираженому експіраторному колапс трахеї і великих бронхів. При гнійному та слизово-гнійному бронхіті хворих більше непокоїть виділення при кашлі мокротиння. У разі загострення хвороби мокротиння набуває гнійного характеру, її кількість збільшується, іноді мокрота виділяється насилу (внаслідок бронхіальної обструкції при загостренні). При обструктивному варіанті бронхіту кашель малопродуктивний та надсадний, супроводжується задишкою, з невеликою кількістю мокротиння. Задишка виникає у всіх хворих на ХБ у різні терміни. Поява у "довго кашляючих" хворих задишки спочатку при значному фізичному навантаженні свідчить про приєднання бронхіальної обструкції. У міру прогресування хвороби задишка стає більш вираженою та постійною, тобто розвивається дихальна (легенева) недостатність. При необструктивному варіанті ХБ прогресує повільно, задишка з'являється зазвичай через 20-30 років після початку хвороби. Такі хворі на початок хвороби майже ніколи не фіксують, а вказують тільки на появу ускладнень або частих загострень. В анамнезі виявляється підвищена чутливість до охолодження, більшість хворих вказують на тривале куріння. У багатьох хворих захворювання пов'язані з професійними шкідливими з виробництва. При аналізі кашльового анамнезу необхідно переконатися у відсутності у хворого на іншу патологію бронхолегеневого апарату (туберкульозу, пухлини, бронхоектазів, пневмоконіозів, системних захворювань сполучної тканини тощо), що супроводжується тими самими симптомами. Іноді в анамнезі вказується кровохаркання через легку ранимість слизової оболонки бронхів. Рецидивне кровохаркання вказує на геморагічну форму бронхіту. Крім цього, кровохаркання при хронічному, тривало протікає бронхіті може бути першим симптомом раку легені або бронхоектазів. 28. Діагностика хронічного бронхіту (ХБ) Діагностика При аускультації виявляються жорстке дихання (при розвитку емфіземи може стати ослабленим) і сухі хрипи розсіяного характеру, тембр яких залежить від калібру уражених бронхів (добрі хрипи, що вислуховуються на видиху, характерні для ураження дрібних бронхів). При загостренні обструктивного бронхіту задишка посилюється, наростають явища дихальної недостатності. У деяких випадках ХБ і при приєднанні ускладнень з'являються ознаки емфіземи легень, дихальної та серцевої (правошлуночкової) недостатності - декомпенсованого легеневого серця: акроціаноз, пастозність або набряклість гомілок і стоп, зміни нігтів у вигляді годинникових стекол, а кінцевих фала вигляді барабанних паличок, набухання шийних вен, пульсація в епігастральній ділянці за рахунок правого шлуночка, акцент II тону у II міжребер'ї зліва від грудини, збільшення печінки. Лабораторно-інструментальні показники мають різну міру значущості залежно від стадії перебігу процесу. Рентгенологічне дослідження органів грудної клітки проводиться всім хворим на ХБ, проте, як правило, на оглядових рентгенограмах зміни в легенях відсутні. Може спостерігатись сітчаста деформація легеневого малюнка, обумовлена розвитком пневмосклерозу. Рентгенологічне дослідження відіграє важливу роль у діагностиці ускладнень (гостра пневмонія, бронхоектази) та у диференціальній діагностиці із захворюваннями зі подібними симптомами. Бронхографія використовується лише для діагностики бронхоектазів. Бронхоскопія має велике значення у діагностиці ХБ та диференціації його від захворювань, що проявляються подібною клінічною картиною. Вона підтверджує наявність запального процесу; уточнює характер запалення; виявляє функціональні порушення трахеобронхіального дерева; допомагає у виявленні органічних уражень бронхіального дерева. Дослідження функції зовнішнього дихання проводять виявлення рестриктивних і обструктивних порушень легеневої вентиляції. За спірограмою розраховують індекс Тіффно та показник швидкості руху повітря – ПСДВ. Визначити рівень обструкції допомагає також спільна оцінка величини бронхіального опору та легеневих обсягів. Радіопульмонографія з використанням радіоактивного ізотопу 133Хе проводиться для виявлення нерівномірності вентиляції, пов'язаної з обструкцією дрібних бронхів. Електрокардіографія необхідна для виявлення гіпертрофії правого шлуночка і правого передсердя, що розвивається при легеневій гіпертензії. Клінічний аналіз крові виявляє вторинний еритроцитоз, що виник унаслідок хронічної гіпоксії при розвитку вираженої легеневої недостатності. "Острофазові" показники виражені помірно. Мікробіологічне дослідження мокротиння та вмісту бронхів є важливим для виявлення етіології загострення хронічного бронхіту та вибору антимікробної терапії. 29. Диференційна діагностика хронічного бронхіту (ХБ) Таблиця Диференційно-діагностичні критерії ХБ
30. Лікування хронічного бронхіту (ХБ) Лікування. Включає комплекс заходів, що різняться у період загострення та ремісії хвороби. У період загострення ХБ виділяються два напрями лікування: етіотропний та патогенетичний. Етіотропне лікування спрямоване на ліквідацію запального процесу в бронхах: показана терапія антибіотиками, сульфаніламідними препаратами, антисептиками, фітонцидами та ін. Починають лікування з антибіотиків пеніцилінового ряду (пеніцилін, ампіцилін) або групи цефалоспоринів резерву (гентаміцин та ін). Найбільш кращий спосіб введення – інтратрахеальний (аерозоль або заливка гортанним шприцом через бронхоскоп). Патогенетичне лікування спрямоване на покращення легеневої вентиляцій; відновлення бронхіальної прохідності; боротьбу з легеневою гіпертензією та правошлуночковою недостатністю. Відновленню легеневої вентиляції, крім ліквідації запального процесу в бронхах, сприяють оксигенотерапія та заняття ЛФК. Основне в терапії ХБ – відновлення прохідності бронхів – досягається шляхом поліпшення їхнього дренажу та ліквідації бронхоспазму. Для поліпшення бронхіального дренажу призначають відхаркувальні (гаряче лужне пиття, відвари трав, мукалтин та ін), муколітичні препарати (ацетилцистеїн, бромгексин; при гнійному в'язкому секреті - аерозолі протеолітичних ферментів - хімопсину, трипсину); використовується лікувальна бронхоскопія. Для ліквідації бронхоспазму використовують еуфілін (внутрішньовенно, у свічках, таблетках), ефедрин, атропін; можливі разові призначення в аерозолі симпатоміметичних препаратів: фенотеролу, орципреналіну сульфату (астмопенту) та нового вітчизняного препарату "Совентол", холінолітичних препаратів: атровенту, тровентолу. Ефективні препарати пролонгованого еуфіліну (теопек, теодур, теобелонг та ін.) – 2 рази на добу. За відсутності ефекту такої терапії вводять невеликі дози кортикостероїдів внутрішньо (10-15 мг преднізолону на добу) або інтратрахеально (суспензія гідрокортизону – 50 мг). Як додаткову терапію призначають: 1) протикашльові препарати: при малопродуктивному кашлі – лібексин, тусупрекс, бромгексин, при надсадному кашлі – кодеїн, діонін, стоптусин; 2) лікарські засоби, що підвищують опірність організму: вітаміни А, С, групи В, біогенні стимулятори. В даний час при лікуванні ХБ все ширше застосовують імунокоригуючі препарати: Т-активін або тималін (по 100 мг підшкірно протягом 3 днів); всередину – катерген, нуклеїнат натрію або пентоксил (протягом 2 тижнів), левамізол (декарис). Фізіотерапевтичне лікування: призначають діатермію, електрофорез хлориду кальцію, кварц на ділянку грудної клітки, масаж грудної клітки та заняття дихальною гімнастикою. 31. Пневмонія. Етіологія, патогенез, класифікація Пневмонія - гостре інфекційно-запальне захворювання, що має осередковий характер, при якому в патологічний процес залучаються респіраторні відділи та інтерстиційна сполучна тканина легень. Класифікація Є. В. Гембицького (1983). За етіологією: 1) бактеріальні (із зазначенням збудника); 2) вірусні (із зазначенням збудника); 3) корнітозні; 4) рикетсіозні; 5) мікоплазмові; 6) грибкові; 7) змішані; 8) інфекційно-алергічні; 9) невстановленої етіології. За патогенезу: 1) первинні; 2) вторинні. Клініко-морфологічна характеристика: 1) паренхіматозні: крупозні; осередкові; 2) інтерстиціальні. По локалізації та протяжності: односторонні; двосторонні. За тяжкістю: украй важкі; важкі; середньої тяжкості; легкі та абортивні. За течією: гострі; затяжні (рентгенологічний та клінічний дозвіл пневмонії). Етіологія. Більшість пневмоній мають інфекційне походження. Пневмонії алергічні та обумовлені дією фізичних чи хімічних факторів трапляються рідко. Бактеріальні пневмонії діагностуються частіше у осіб середнього та похилого віку; вірусні пневмонії – у молодих. В етіології первинних бактеріальних пневмоній провідна роль належить пневмококам. У період епідемії грипу зростає роль вірусно-бактеріальних асоціацій (частіше за стафілококи), а також умовно-патогенних мікроорганізмів. При вторинних пневмоніях провідну етіологічну роль грають грамнегативні бактерії (клебсієла пневмонії та паличка інфлюенцы); у виникненні аспіраційних пневмоній велике значення анаеробної інфекції. Патогенез. Інфекційний збудник потрапляє ззовні до респіраторних відділів легень через бронхи: інгаляційно та аспіраційно (з носо- або ротоглотки). Гематогенним шляхом збудник потрапляє до легень переважно при вторинних пневмоніях або при тромботичному генезі пневмоній. Лімфогенне поширення інфекції з появою пневмонії спостерігається лише при пораненнях у грудну клітину. Істотне значення у патогенезі пневмоній надається також алергічним та аутоалергічним реакціям. 32. Діагностика пневмонії Найбільш значущим для діагнозу є наявність синдрому запальних змін легеневої тканини. Цей синдром становлять такі симптоми: 1) відставання при диханні ураженої сторони грудної клітки; 2) скорочення перкуторного звуку в області проекції ураження на більшому або меншому протязі; 3) посилення голосового тремтіння та бронхофонії у тій же зоні; 4) зміна характеру дихання (жорстке, бронхіальне, ослаблене тощо); 5) поява патологічних дихальних шумів (вологі дзвінкі хрипи і крепітація). Характер дихання може змінюватись по-різному. У початковій стадії крупозної пневмонії дихання може бути ослабленим, з подовженим видихом; у фазі печінки поряд із наростанням тупості перкуторного звуку прослуховується бронхіальне дихання; при вирішенні пневмонічного вогнища із зменшенням перкуторної тупості дихання стає жорстким. Поставити етіологічний діагноз допомагають симптоми: 1) виявлення дрібноплямистої, як при краснусі, висипки в поєднанні з лімфоаденопатією характерно для аденовірусної інфекції; 2) локальне збільшення лімфатичних вузлів говорить про перифокальну пневмонію; 3) грибкові пневмонії поєднуються з ураженням слизових оболонок, шкіри та нігтів; 4) гепатолієнальний синдром і невелика жовтяниця зустрічаються при корнітозних та куриккетсіозних пневмоніях; 5) для типових крупозних пневмоній характерний вид хворого: бліде обличчя з гарячковим рум'янцем на стороні поразки, герпетичні висипання, роздмухування крил носа при диханні. Найбільш важливим методом, що дозволяє уточнити наявність пневмонії та ступінь залучення до процесу легеневої тканини, є великокадрова флюорографія та рентгенологічне дослідження органів грудної клітки. Бронхографія виявляє порожнини розпаду в легеневій тканині, а також наявність бронхоектазів, навколо яких при загостренні можливі інфільтративні зміни (періфокальна пневмонія). Бактеріологічне дослідження мокротиння (або бронхіальних змивів) до призначення антибіотиків допомагає виявити збудник та визначити його чутливість до антибіотиків. Про гостроту запального процесу судять за вираженістю острофазових показників крові та їх динаміці (лейкоцитоз зі зсувом лейкоцитарної формули, збільшення ШОЕ, підвищений вміст a2-глобулінів, фібриногену, поява СРВ, підвищення рівня сіалових кислот). При затяжному перебігу пневмонії та розвитку ускладнень вивчають імунологічну реактивність організму. 33. Лікування пневмонії Лікування. Безпосередньо після встановлення діагнозу необхідно приступати до етіотропної терапії пневмонії. Велике значення набувають емпіричних уявлень про можливий збудник, оскільки бактеріологічне дослідження мокротиння проводиться протягом досить тривалого часу і у більшості хворих навіть при сучасному підході до цього дослідження дає невизначені, а іноді помилкові результати. На даний момент пеніциліни втратили своє значення як препарат вибору терапії пневмоній. У зв'язку з вищесказаним у терапії пневмоній значну увагу приділяють макролідам, які довели свою ефективність не тільки проти пневмокока, а й щодо Mycoplasma pneumoniae, Chlamydia pneumoniae. Дозування антибіотиків, що використовуються при лікуванні пневмоній. 1. Пеніциліни: бензилпеніцилін (500 000-1 000 000 ОД внутрішньовенно кожні 6-8 год або по 500 000-1 000 000 ОД кожні 4 год внутрішньом'язово), ампіцилін (0,5 1,0-2,0 годин або 6 г кожні 8 годин внутрішньовенно), амоксицилін (0,5-6 г кожні 0,5 годин перорально або 1,0-8 г кожні 0,5-1,0 годин внутрішньом'язово, внутрішньовенно), оксацилін ( 8 г кожні 12-0,5 годин перорально, внутрішньом'язово, внутрішньовенно). 2. Цефалоспорини: I покоління - цефалотин (кефлін) (0,5-2,0 г кожні 4-6 год внутрішньом'язово, внутрішньовенно), цефазолін (кефзол) (0,5-2,0 г, кожні 8 год внутрішньом'язово, внутрішньовенно) ), ІІ покоління - цефу-роксим (зінацеф, кетоцеф) (0,75-1,5 г кожні 6-8 год внутрішньом'язово, внутрішньовенно), ІІІ покоління - цефотаксим (клафоран) (1,0-2,0 г, максимально до 12 г/добу кожні 12 годин внутрішньом'язово, внутрішньовенно), цефтріаксон (лонгацеф, роцефін) (1,0-2,0-4,0 г кожні 24 год внутрішньом'язово, внутрішньовенно). 3. Аміноглікозиди: генетаміцин (80 мг кожні 12 год внутрішньом'язово, внутрішньовенно), амікацин (10-15 мг/кг кожні 12 год внутрішньом'язово, внутрішньовенно), тобраміцин (бруламіцин) (3-5 мг/кг кожні 8 год . 4. Макроліди: еритроміцин (0,5 г кожні 6-8 год перорально або 0,5-1,0 г кожні 6-8 год внутрішньовенно), роваміцин (3,0 млн. МО кожні 8-12 год перорально або 1,5, 3,0-8 млн. ME кожні 12-XNUMX год внутрішньовенно). 5. Фторхінолони: пефлоксацин (лефлацин) (400 мг кожні 12 год перорально, внутрішньовенно), ципрофлоксацин (ципробай) (500 мг кожні 12 год перорально або 200-400 мг кожні 12 год внутрішньовенно), ч кожні 200 год перорально). 6. Тетрацикліни: доксициклін (вібраміцин) (200 мг у 1-й день, у наступні дні – по 100 мг кожні 24 год перорально), міноциклін (міноцин) (200 мг у 1-й день, у наступні дні – по 100 мг кожні 12 год перорально), азтреонам (азактам) (1,0-2,0 г кожні 8-12 год), іміпенем/цилстатин (тієнам) (500 мг кожні 6-8 год внутрішньом'язово). 34. Етіологія, патогенез, клінічна картина гострого езофагіту Гострий езофагіт - запальне ураження слизової оболонки стравоходу тривалістю від кількох днів до 2-3 місяців. Етіологія та патогенез. Етіологічні чинники: інфекційні захворювання, травми, опіки, отруєння, алергічні реакції, аліментарні похибки. З інфекційних агентів найбільш характерні для гострого езофагіту дифтерія, скарлатина, черевний та висипний тифи, грип, парагрип, аденовірусна інфекція, епідемічний паротит. Фізичні та хімічні фактори, що пошкоджують, представлені іонізуючою радіацією, хімічними опіками, гарячою і дуже холодною їжею, прянощами. Клінічна картина. Катаральний езофагіт - найпоширеніша форма гострого езофагіту. Виникає на тлі похибок у харчуванні: при вживанні гострих, холодних, гарячих страв, при дрібних травмах, спиртових опіках. Клінічно проявляється печінням та болем за грудиною, які змушують хворих на кілька днів відмовлятися від їжі. Ендоскопічно відзначається езофагіт І-ІІ ступеня, рентгенологічно – гіперкінезія стравоходу. Ерозивний езофагіт виникає при інфекційних захворюваннях та алергозах. Клінічна симптоматика аналогічна така при катаральному езофагіті. Геморагічний езофагіт - рідкісний клінічний різновид ерозивного езофагіту. Етіологія та сама, як і при ерозивному эзофагите. Клінічно типові інтенсивний больовий синдром та криваве блювання. У клініці превалюють дисфагія та інтенсивний больовий синдром, що посилюється після їжі, нудота, блювання. З блювотними масами виділяються плівки фібрину, можливо кровохаркання. Мембранозний (ексфоліативний) езофагіт з етіології буває хімічним (опіки стравоходу), інфекційним. У клініці важкого мембранозного езофагіту переважають інтоксикація, дисфагія та больовий синдром. Некротичний езофагіт – рідкісна форма гострого запалення стравоходу. Його розвитку сприяють знижений імунітет при таких тяжких захворюваннях як сепсис, черевний тиф, кандидамікоз, термінальна стадія ниркової недостатності. Клініка характеризується хворобливою дисфагією, блюванням, загальною слабкістю, кровотечами, частим розвитком медіастиніту, плевриту, пневмонії. Септичний езофагіт - рідкісне локальне або дифузне запалення стінок стравоходу стрептококової етіології або виникає при пошкодженні слизової оболонки стороннім тілом, при опіках, виразках, може переходити з сусідніх органів. Іноді зустрічається гострий флегмонозний езофагіт як ускладнення будь-якої форми гострого езофагіту, що призводить до гнійного розплавлення стінок стравоходу. Клінічна картина характеризується вираженою інтоксикацією, високою температурою, болями за грудиною та в ділянці шиї, блюванням. При огляді відзначається припухлість у ділянці шиї, рухливість у цьому відділі хребта обмежена. Положення голови – вимушене, з нахилом в один бік. Захворювання нерідко трансформується у гнійний медіастиніт. 35. Лікування та прогноз гострого езофагіту Лікування. Принципи лікування гострого езофагіту: етіотропне, патогенетичне та симптоматичне. Етіотропне лікування – лікування основного захворювання. При інфекційних захворюваннях, що ускладнилися гострим езофагітом, застосовують антибіотики (парентерально). При виражених некротичних та геморагічних змінах у стравоході рекомендовано утриматися від їди на 2-3 тижні. У цей період показано парентеральне харчування, внутрішньовенне введення білкових гідролізатів, сумішей амінокислот, інтраліпіду, вітамінів, дезінтоксикаційну терапію. Після зменшення запальних явищ призначають термічно та хімічно щадні продукти харчування: тепле молоко, вершки, овочеві супи, рідкі каші. Для зменшення місцевих симптомів запалення - внутрішньо розчини таніну 1%-ний, коларголу - 2%-ний, новокаїну - 1-2%-ний перед їжею. Приймають в'яжучі препарати в горизонтальному положенні з низько опущеним узголів'ям ліжка. За відсутності ефекту від місцевого прийому в'язких препаратів призначаються парентерально ненаркотичні анальгетики. Для зменшення явищ стравохідної дискінезії використовуються прокінетичні препарати (церукал, реглан, цизаприд) перед їжею. При множинних ерозіях показані препарати вісмуту (денол, вікар), ін'єкції солкосерилу. При геморагічному езофагіті, що ускладнився кровотечею, застосовують препарати амінокапронової кислоти, вікасол, діцинон. При масивному кровотечі призначають переливання крові чи плазми. При гнійних, некротичних езофагітах пацієнт довго повинен перебувати на парентеральному харчуванні, застосовується масивна терапія кількома антибіотиками, проводиться дренування гнійника. Корекція стриктур стравоходу здійснюється за допомогою їхнього бужування. В ексквізитних випадках накладається гастростома. Прогноз. Прогноз катарального та ерозивного езофагітів сприятливий. Можливе мимовільне зникнення симптомів езофагіту за умови адекватної корекції основного захворювання. Прогноз псевдомембранозного, екфоліативного, флегмонозного езофагітів серйозний. У всіх випадках за умови одужання від основного захворювання езофагіт закінчується утворенням рубцевих стриктур, які надалі вимагають корекції. Хворі з тяжкими формами езофагіту, що ускладнився стриктурами стравоходу, непрацездатні. Профілактика гострих езофагітів полягає в адекватній та своєчасній діагностиці та лікуванні основного захворювання. 36. Етіологія, патогенез, клінічна картина хронічного езофагіту Хронічний езофагіт – хронічне запалення слизової оболонки стравоходу тривалістю до 6 місяців. Найбільш поширений варіант - пептичний езофагіт (рефлюкс-езофагіт), який може ускладнюватись пептичною виразкою стравоходу. Етіологія та патогенез. Головна причина захворювання – постійний рефлюкс у стравохід шлункового вмісту, іноді жовчі та кишкового вмісту, тобто пептичний езофагіт – це асептичний опік стравоходу кислотою шлунка. У патогенезі рефлюкс-езофагіту мають значення регургітація кислого вмісту та порушення очищення та спорожнення від нього стравоходу. Існує п'ять критеріїв патогенності рефлюксу в генезі пептичного езофагіту: частота, об'єм, регургітація, хімічний склад, стан слизової оболонки стравоходу і чутливість до хімічного фактору (запалення стінок знижує чутливість), швидкість спорожнення (кліренс), що залежить в основному від активної слини та слизу. Виникненню рефлюкс-езофагіту сприяють грижі стравохідного отвору діафрагми, виразкова хвороба дванадцятипалої кишки, постгастрорезекційні порушення, алергози. Значення має і алергічна схильність. При морфологічному дослідженні у хворих на пептичний езофагіт відзначаються набряк, гіперемія слизової оболонки, інфільтрація підслизової оболонки наддіафрагмального сегмента стравоходу. Клінічна картина. До типових ознак рефлюкс-езофагіту відносять печіння за грудиною, печію, відрижка, яке посилюються в положенні лежачи, дисфагію, позитивний ефект від прийому антацидів. Можуть виникати болі за грудиною після їди, що нагадують стенокардитичні. Виникнення болю при рефлюкс-езофагіті пов'язують з пептичним роздратуванням стінки стравоходу та його спазмами під час регургітації кислого шлункового вмісту, а також з утиском пролабованої слизової оболонки. Відмінні риси цього болю: тривалий, пекучий її характер, локалізація в ділянці мечоподібного відростка, іррадіація по ходу стравоходу, рідше – у ліву половину грудної клітки, відсутність помітного ефекту від прийому антацидів, спазмолітиків, посилення у горизонтальному положенні, особливо після їди. Особливу увагу в клінічній діагностиці слід приділяти малим симптомам дисфагії, таким як відчуття грудки за грудиною, відчуття проходження гарячої їжі стравоходом. Ознакою езофагіту, що поволі починається, можуть бути слинотеча і звичка запивати їжу водою. Фізичне обстеження пацієнтів із рефлюкс-езофагітом не дає діагностично значущої інформації. До ускладнень рефлюкс-езофагіту відносять кровотечі, виразки, стриктури, скорочення стравоходу, малігнізацію. Хронічний рефлюкс-езофагіт може призводити до розвитку аксіальної грижі стравохідного отвору діафрагми. 37. Діагностика, лікування хронічного езофагіту Діагностика та диференціальний діагноз. Найбільш цінним методом досліджень при цій патології є ендоскопія, в ході якої відзначаються гіперемія, набряк, потовщення складок слизової оболонки. Диференціювати рефлюкс-езофагіт необхідно з виразковою хворобою шлунка та дванадцятипалої кишки, ішемічною хворобою серця, хронічним холециститом та панкреатитом. Провідним симптомом під час проведення диференціальної діагностики є біль. Диференціації з виразковою хворобою допомагають відсутність при езофагіті пізніх та "голодних" болів, а також дані, отримані при ендоскопії стравоходу та шлунка. Для коронарного болю, на відміну від езофагіту, характерні зв'язок з фізичним та емоційним навантаженням, ефект від нітратів, ознаки ішемії на ЕКГ, у тому числі і за даними велоергометрії. Дані УЗД органів черевної порожнини допомагають виключити патологію жовчного міхура та підшлункової залози як причину больового синдрому. Лікування. Терапія рефлюкс-езофагіту включає лікування захворювань, що його викликали, і призначення антирефлюксної терапії. Пацієнтам рекомендують виключити підйом ваг, нахили. Необхідно приймати правильне положення під час відпочинку та сну (підголів'я піднесене на 15-20 см, під кутом 30-50). Рекомендується нормалізувати масу тіла, харчуватися дрібно (останній прийом їжі - за 3 години до сну). З раціону виключають алкоголь, гострі страви. Призначають адсорбенти та олужнюючі препарати, що надають протективну дію на слизову оболонку. До таких речовин відноситься вентер, який призначають внутрішньо по 1 г (краще у вигляді суспензії) за 30-40 хв до їди 3 рази на день і 4-й раз – натще перед сном. Курс лікування – 8-10 тижнів. Аналогічну дію мають алмагель, фосфалюгель, маалокс, гастал. Ці препарати застосовують у міжтравний період (через 1/2-2 год після їди та на ніч) до настання повної ремісії. Фосфалюгель і маалокс призначають по 1-2 пакети 2-3 рази на добу, гастал - по 2-3 таблетки на добу. Чайну соду, суміш Бурже, білу глину у зв'язку з недостатньою ефективністю застосовувати недоцільно. Обволікаючу та в'яжучу дію надає нітрат вісмуту по 1 г 3-4 рази на день. Відзначено високу антирефлюксну активність нового антациду - топалкану. Вилужуючий ефект мають мінеральні води - "Боржомі", "Єсентуки № 4", "Джермук", "Смирновська". Для зменшення кислої шлункової секреції призначають блокатори Н2-рецепторів гістаміну (циметидин, ранітидин, фамотидин), інгібітори Ка-К-АТФази (омепразол), селективний блокатор М-холінорецепторів клітин обкладинки, його аналог бускопан. Прогноз та профілактика. Прогноз для життя та трудової діяльності сприятливий. При ускладненому перебігу прогноз визначається своєчасністю та якістю надання медичної допомоги. Пацієнтам з тяжким перебігом встановлюється група інвалідності. Хворі з хронічним рефлюкс-езофагітом повинні перебувати під наглядом гастроентеролога. Не рідше 2 разів на рік показані ендоскопічні та морфологічні дослідження у зв'язку з можливістю малігнізації. 38. Виразка стравоходу Виразка стравоходу - гостре або хронічне захворювання, що характеризується виразкою слизової оболонки дистального відрізка стравоходу під впливом активного шлункового соку. Етіологія та патогенез. Хронічні пептичні виразки стравоходу є ускладненнями рефлюкс-езо-фагіту та хіатальної грижі. Їх виникненню сприяють внутрішній короткий стравохід, осередкова метаплазія слизової оболонки, гетеротопія слизової оболонки шлунка в стравохід, рефлюксна хвороба при недостатності кардії, захворювання, що супроводжуються частою блювотою (постваготомічний синдром, синдром петлі, хронічний алкоголізм). Клінічна картина. Симптоми виразки стравоходу нагадують клініку пептичного езофагіту: завзята печія, що посилюється після їжі, при нахилі тулуба, в положенні лежачи, виникають відрижка, біль при ковтанні, порушення проходження твердої їжі. Клінічні симптоми перфорації не відрізняються від симптомів гострої проникаючої та непроникаючої механічної травми сторонніми тілами. Пенетрують в навколишні тканини приблизно 14% виразок стравоходу. Діагностика та диференціальний діагноз. За клінічними симптомами запідозрити виразку пептики вкрай важко. Діагноз верифікується в ході інструментального та лабораторного дослідження. Найбільш інформативно рентгенологічне та ендоскопічне дослідження. Найбільш достовірні відомості у верифікації виразки стравоходу дають ендоскопія і множинна біопсія з країв виразки. При просуванні ендоскопа до виразки виявляються ознаки езофагіту I-IV стадії, моторна дисфункція стравоходу, перифокальний набряк і гіперемія слизової оболонки. Слід диференціювати пептичні виразки стравоходу з виразками специфічного характеру (при туберкульозі, сифілісі). У цих ситуаціях суттєво допомагають специфічні серологічні тести, результати гістологічного та бактеріологічного досліджень. Поєднання патології стравоходу з ураженням легень та інших органів змушує цілеспрямовано обстежити хворого щодо специфічного процесу. Лікування. Лікування включає призначення дієти: рекомендується механічно та хімічно щадна їжа, яка приймається невеликими порціями 5-6 разів на день. Для запобігання рефлюксу вмісту зі шлунка в стравохід положення хворого в ліжку має бути з піднятим узголів'ям. Медикаменти приймають лежачи. Призначають монотерапію препаратом однієї з наступних фармакологічних груп: антисекреторні, у тому числі антациди та адсорбенти, стимулятори моторно-евакуаторної функції шлунка (прокінетики), препарати – імітатори слизу. Терапія здійснюється тривало – 1,5-3 місяці. Показання до хірургічного лікування – відсутність загоєння протягом 6-9 місяців, ускладнений перебіг (перфорація, пенетрація, стеноз, кровотеча). Прогноз та профілактика. Прогноз для життя та трудової діяльності сприятливий. 39. Етіологія, патогенез, клінічна картина хронічного гастриту Хронічний гастрит – це захворювання, яке клінічно характеризується шлунковою диспепсією, а морфологічно – запальними та дистрофічними змінами слизової оболонки шлунка, порушенням процесів клітинного оновлення, збільшенням числа плазматичних клітин та лімфоцитів у власній мембрані слизової оболонки. Етіологія та патогенез. На етапі розвитку гастроентерології встановлено, що появі хронічного гастриту сприяє мікробна експансія Helicobacter pylori (НР), що у 95 % випадків викликає антральний гастрит й у 56 % - пангастрит. Етіологічні фактори виникнення хронічного гастриту можна з великою часткою впевненості віднести до факторів ризику (нерегулярне незбалансоване харчування, куріння, алкоголь, гіперсекреція соляної кислоти і пепсину). Провідна роль у розвитку захворювання також належить аутоімунним механізмам, що супроводжуються накопиченням антитіл до парієтальних клітин слизової оболонки шлунка, обтяженої спадковості, а також прийому медикаментів, що надають шкідливу дію на слизову оболонку шлунка. Класифікація. У 1990 р. на IX Міжнародному конгресі гастроентерологів в Австралії було прийнято нову систематизацію хронічного гастриту, названу Сіднейською системою. Гістологічні засади класифікації. 1. Етіологія: хронічний гастрит, що асоціюється з НР, аутоімунний, ідіопатичний, гострий медикаментозний гастрит. 2. Топографія: антральний, фундальний, пангастрит. 3. Морфологія: гостра, хронічна, особливі форми. Ендоскопічні основи класифікації: 1) гастрит антрального відділу шлунка; 2) гастрит тіла шлунка; 3) пангастрит; 4) зміни слизової оболонки шлунка: набряк, еритема, ранимість слизової оболонки, ексудат, плоскі ерозії, підняті ерозії, гіперплазія складок, атрофія складок, видимість судинного малюнка, надслизові крововиливи. Клінічна картина. Хронічний гастрит – одне з найпоширеніших захворювань у клініці внутрішніх хвороб. Його частота у мешканців земної кулі коливається в межах від 28 до 75%. Хронічний гастрит частіше проявляється симптомами шлункової диспепсії та болем в епігастральній ділянці. Рідше він протікає безсимптомно. Не менш важливе місце в клінічній картині хронічного гастриту займає диспепсичний синдром: нудота, відрижка (кислим, гірким, тухлим), печія, запор або пронос, нестійкий стілець. При ізольованому антральному гастриті першорядними стають скарги на печію та запор, що виникають внаслідок гіперсекреції соляної кислоти та пепсину. 40. Діагностика та лікування хронічного гастриту Діагностика. Хронічний гастрит тече тривало, з наростанням симптоматики з часом. Загострення провокуються аліментарними порушеннями. Фізика картина хронічного гастриту досить мізерна. У 80-90% хворих під час загострення захворювання при об'єктивному дослідженні визначається лише локальна болючість в епігастральній ділянці. При поєднанні хронічного гастриту з дуоденітом, холецистит або панкреатитом може визначатися не типова для гастриту локалізація болю, але властива патології іншого органу. Рентгенологічне обстеження швидше дозволяє виключити інші захворювання шлунка (виразку, рак), допомогти у діагностиці хвороби Менетріє, ніж підтвердить діагноз хронічного гастриту. Через мізерність клінічних проявів захворювання, а також неспецифічність лабораторних досліджень діагноз хронічного гастриту базується на результатах ендоскопічного та морфологічного дослідження. Ендоскопія виявляє різну вираженість зміни слизової оболонки шлунка: набряк, еритема, ранимість слизової оболонки, ексудат, плоскі ерозії, підняті ерозії, гіперплазія або атрофія складок, видимість судинного малюнка, підслизові крововиливи. Клінічні прояви, властиві гастриту, спостерігаються при інших захворюваннях органів травлення, тому в процесі діагностики необхідні УЗД черевної порожнини, ретельне ендоскопічне та морфологічне дослідження органів травлення. Лікування. Хворі на гастрит потребують заходів загальномедичного характеру: регулярного збалансованого харчування, нормалізації режиму праці та відпочинку, нівелювання стресових ситуацій побутового та виробничого плану. Медикаментозна терапія показана лише за наявності клінічних проявів хронічного гастриту. Хворі на гастрит, асоційований з НР, лікуються за програмою виразкової хвороби (див. наступну лекцію). Особи з аутоімунним гастритом потребують призначення вітаміну В12 (по 500 мкг 1 раз на день підшкірно протягом 30 днів з наступним повторенням курсів лікування), фолієвої кислоти (по 5 мг на добу), аскорбінової кислоти (до 1 г на добу). За необхідності проводиться замісна терапія ферментними препаратами (мезим-форте, фесталом, ензисталом, креоном, панцитратом, ацидин-пепсином). Больовий синдром зазвичай усувають призначенням антацидів (маалоксом, алмагелем, гасталом) або блокаторів Н-гістамінорецепторів (ранитидину, фамотидину) у середніх терапевтичних дозах. При особливих формах гастриту потрібне лікування основного захворювання. Прогноз та профілактика. Прогноз для життя та трудової діяльності сприятливий. Профілактика гастриту зводиться до раціонального харчування, дотримання режиму праці та відпочинку, обмеження прийому НПЗЗ. 41. Етіологія виразкової хвороби шлунка Виразкова хвороба (пептична виразка) - хронічне, рецидивне захворювання, що клінічно проявляється функціональною патологією гастродуоденальної зони, а морфологічно - порушенням цілісності її слизового та підслизового шарів, у зв'язку з чим виразковий дефект завжди гоїться з утворенням рубця. Етіологія. Основним етіологічним чинником виразкової хвороби є мікробна експансія НР лежить на поверхні епітелію шлунка. Значення бактеріальної агресії в етіології захворювання вивчається з 1983 р., коли Дж. Уоррен та Б. Маршалл повідомили про виявлення великої кількості S-спіралеподібних бактерій на поверхні епітелію антрального відділу шлунка. Хелікобактерії здатні існувати в кислому середовищі завдяки продукції ферменту уреази, що перетворює сечовину (з кровоносного русла) на аміак та вуглекислий газ. Продукти ферментативного гідролізу нейтралізують соляну кислоту та створюють умови для зміни рН середовища навколо кожної бактеріальної клітини, таким чином забезпечуються сприятливі умови для життєдіяльності мікроорганізмів. Не менш важливими у розвитку виразки є нервово-психічні впливи, спадкова схильність, інфекційні агенти, аліментарні похибки та прийом деяких медикаментів, шкідливі звички. Популярністю серед дослідників користуються спадкові фактори: інертність основних нервових процесів, групоспецифічні властивості крові, імунологічні та біохімічні особливості, синдром спадкової обтяженості. У виникненні виразкової хвороби значне значення надавалося аліментарним порушенням. Однак проведені в останні два десятиліття клініко-експериментальні дослідження в більшості випадків не виявили шкідливої дії харчових продуктів на слизову оболонку гастродуоденальної області. Поширеність виразкової хвороби серед значних контингентів осіб із різним характером харчування також свідчить проти провідного значення аліментарних факторів. Істотне значення для виникнення виразки мають порушення ритму та регулярності харчування, великі перерви між прийомами їжі, несвоєчасність її прийняття. Дослідники висловлюють відносно суперечливі погляди щодо ролі алкоголю у ульцерогенезі. Відомо, що алкоголь спричиняє атрофічні зміни слизової оболонки шлунка. Ці спостереження перебувають у суперечності із загальною концепцією виразкоутворення. Активно вивчається роль лікарських впливів у ульцерогенезі. Опубліковані в літературі результати досліджень та власні дані свідчать про те, що найбільш вираженими ульцерогенними властивостями володіють нестероїдні протизапальні засоби та глюкокортикоїдні гормони. 42. Діагностика виразкової хвороби шлунка Діагностика При неускладненому перебігу виразкової хвороби у загальному аналізі крові зміни відсутні, можливе деяке зниження ШОЕ, незначний еритроцитоз. При приєднанні ускладнень в аналізах крові з'являються анемія, лейкоцитоз – при залученні до патологічного процесу очеревини. У загальному аналізі сечі змін немає. Традиційний метод дослідження при патології шлунка – визначення кислотності шлункового вмісту. Можливі різні показники: підвищені та нормальні, у ряді випадків – навіть знижені. Виразка дванадцятипалої кишки протікає із високою кислотністю шлункового соку. При рентгенологічному дослідженні виразкова хвороба являє собою "нішу" - депо барієвої суспензії. Гастродуоденоскопія з біопсією є найнадійнішим методом діагностики виразкової хвороби. Вона дозволяє оцінити характер змін слизової оболонки в краї виразки, у периульцерозній зоні та гарантує точність діагнозу на морфологічному рівні. При ендоскопічному та морфологічному дослідженнях встановлено, що більшість виразок шлунка розташовується в області малої кривизни та антрального відділу, набагато рідше – на великій кривизні та в зоні пілоричного каналу. 90% дуоденальних виразок знаходиться у бульбарному відділі. При морфологічному дослідженні біоптату, отриманого з дна і країв виразки, виявляється клітинний детріт у вигляді скупчення слизу з домішкою лейкоцитів, що розпадаються, еритроцитів і злущених клітин епітелію з розташованими під ними колагеновими волокнами. 43. Лікування виразкової хвороби шлунка Лікування. Раціональна терапія пептичної виразки повинна включати режим, відповідне харчування, медикаментозне лікування, психотерапію, фізичні та санаторно-курортні методи лікування. У період загострення виразкової хвороби необхідно суворо дотримуватись дробності в харчуванні (від 4 до 6 разів на добу з малим обсягом кожної порції їжі, що приймається в певний час). Харчові продукти повинні мати хороші буферні властивості і містити достатню кількість білка (120-140 г). Психотерапія має істотне значення для усунення або зменшення психоневротичних реакцій, що виникають внаслідок наполегливого больового синдрому та його очікування. Медикаменти, що застосовуються для лікування виразки, діляться на 5 груп: 1) препарати, що впливають на кислотно-пептичний фактор (антациди та Н2-блокатори гістаміну, інші антисекреторні засоби); 2) препарати, що покращують слизовий бар'єр шлунка; 3) препарати, які збільшують синтез ендогенних простагландинів; 4) антибактеріальні та антисептичні засоби; 5) препарати, що нормалізують моторно-евакуаторні порушення шлунка та дванадцятипалої кишки. Антациди: 1) розчинні (всмоктуються) – двовуглекисла сода, карбонат кальцію (крейда) та окис магнію (палена магнезія); 2) нерозчинні (невсмоктуються): трисилікат магнію та гідроксид алюмінію. Декілька схем комбінованої терапії (двох-, трьох-, чотирикомпонентна). Двокомпонентна терапія: амоксицилін по 1000 мг 2 рази на день протягом 2 тижнів; омепразол по 40 мг двічі на добу. Трикомпонентна схема містить препарат колоїдного вісмуту по 2 мг 120 рази на добу; тетрациклін по 4 мг 250 рази на день; метронідазол по 4 мг 250 рази на день. Цикл терапії – 4 днів. Чотирикомпонентна схема передбачає омепразол по 20 мг 2 рази на добу з 1-го по 10-й день; денол по 120 мг 4 рази на добу з 4-го до 10-го дня; тетрациклін по 500 мг 4 рази на добу з 4-го до 10-го дня; метронідазол по 500 мг 3 рази на добу з 4-го до 10-го дня. Найбільш ефективною визнана чотирикомпонентна схема терапії виразкової хвороби шлунка та дванадцятипалої кишки. Через 6 тижнів після її проведення загоєння пептичного дефекту відзначається у 93-96% хворих. Після рубцювання виразки шлунка і дванадцятипалої кишки традиційно використовуються два види лікування. 1. Безперервна підтримуюча терапія проводиться антисекреторними препаратами у половинній добовій дозі на період до одного року. 2. Терапія "на вимогу" передбачає використання одного з антисекреторних засобів у половинній добовій дозі протягом двох тижнів при появі симптомів виразкової хвороби. 44. Хронічний ентерит. Етіологія, патогенез, класифікація Хронічний ентерит - захворювання тонкої кишки, що характеризується порушенням її функцій (перетравлення та всмоктування) на тлі дистрофічних та дисрегенераторних змін, що завершуються розвитком запалення, атрофії та склерозу слизової оболонки тонкої кишки. Етіологія та патогенез. Це поліетиологічне захворювання, яке може бути результатом гострого запалення тонкої кишки або первинним хронічним процесом. В останні роки велике значення як етіологічний фактор хронічного ентериту надається ієрсиніям, хелікобактеріям, протею, синьогнійній паличці, ротавірусам, численним представникам найпростіших і гельмінтів (лямбліям, аскаридам, лентецям, опісторхіям, криптоспорідіям). Велике значення у виникненні хронічного ентериту відіграють аліментарні фактори – переїдання, їжа всухом'ятку, незбалансована, переважно вуглеводна їжа, зловживання прянощами. До виникнення ентериту призводять іонізуюче випромінювання, вплив токсичних речовин, лікарських препаратів. Серед загальних патогенетичних механізмів хронізації захворювань тонкої кишки виділяють зміни мікрофлори кишківника на тлі зниження місцевого та загального імунітету. Зміни імунного статусу - зниження вмісту секреторного lgА, підвищення рівня lgЕ, зниження бласттрансформації лімфоцитів та пригнічення міграції лейкоцитів - призводять до колонізації тонкої кишки представниками умовно-патогенної мікрофлори та зниження показників нормальної анаеробної флори. Морфологічно хронічний ентерит проявляється запальними та дисрегенераторними змінами слизової оболонки тонкої кишки. Якщо процес прогресує, спостерігаються її атрофія та склероз. Класифікація (Златкіна А. Р., Фролькіс А. В., 1985). 1. Етіологія: кишкові інфекції, глистяні інвазії, аліментарні, фізичні та хімічні фактори, хвороби шлунка, підшлункової залози, жовчних шляхів. 2. Фази захворювання: загострення; ремісія. 3. Ступінь тяжкості: легка; середньоважка; важка. 4. Течія: монотонна; рецидивуючий; безперервно рецидивуючий; латентне. 5. Характер морфологічних змін: еюніт без атрофії; еюніт з помірною парціальною атрофією ворсин; еюніт з парціальною атрофією ворсин; еюніт з тотальною атрофією ворсин. 6. Характер функціональних порушень: порушення мембранного травлення (дисахаридазна недостатність), порушення всмоктування води, електролітів, мікроелементів, вітамінів, білків, жирів, вуглеводів. 7. Ускладнення: солярит, неспецифічний мезаденіт. 45. Клінічна картина та діагностика хронічного ентериту Клінічна картина. Клінічна картина хронічного ентериту складається з місцевого та загального ентерального синдромів. Перший обумовлений порушенням процесів пристінкового (мембранного) та порожнинного травлення (мальдігестія). Хворі скаржаться на метеоризм, біль у параумбілікальній зоні, здуття живота у формі ковпака, гучне бурчання, проноси, рідше – запори. При пальпації виявляються болючість у мезогастрії, а також ліворуч і вище пупка (позитивний симптом Поргеса), шум плескоту в ділянці сліпої кишки (симптом Образцова). Кал набуває глинистого вигляду, характерна поліфекалію. Загальний ентеральний синдром пов'язаний із порушенням всмоктування харчових інгредієнтів (мальабсорбція), внаслідок чого виникають розлади всіх видів обміну речовин, змінюється гомеостаз. Характерні багатогранні порушення метаболізму, насамперед білкового, що проявляється прогресуючою втратою маси тіла. Зміни вуглеводного обміну виражені менш значно, що проявляється здуттям, бурчанням у животі та посиленням проносів на фоні прийому молочних продуктів. Значною мірою дефіцит маси тіла у хворих зумовлений не лише білковим, а й ліпідним дисбалансом. Зі змінами ліпідного обміну тісно пов'язані порушення обміну жиророзчинних вітамінів та мінеральних речовин (кальцію, магнію, фосфору). Характерними ознаками кальцієвої недостатності є позитивний симптом м'язового валика, судоми, що періодично виникають "немотивовані" переломи кісток, остеопороз, остеомаляція. Діагностика та диференціальний діагноз. У загальному аналізі крові виявляють мікро- та макроцитарну анемію, збільшення ШОЕ, у важких випадках – лімфо- та еозинопенію. При паразитарному походженні захворювання в крові можуть спостерігатися лімфоцитоз, еозинофілія. При копрологічному дослідженні виявляють кишковий тип стеатореї за рахунок жирних кислот та мил, креаторею, амілорею. Збільшується вміст ентерокінази та лужної фосфатази в калі. Добова маса фекалій значно зростає. У біохімічному аналізі крові виявляють гіпопротеїнемію, гіпоальбумінемію, гіпоглобулінемію, гіпокальціємію, зниження рівня магнію, фосфору, інших мікроелементів, порушення електролітного обміну у вигляді зниження рівня натрію та калію. Морфологічна картина легкої форми хронічного ентериту характеризується потовщенням ворсинок, їх деформацією, зменшенням глибини виїмок, зниженням тонусу гладких м'язів, подепітеліальним набряком, дистрофічними змінами поверхні епітелію, витонченням щіткової облямівки клітин, зменшенням числа келихоподібних клітин в області ворсинок, збільшенням слизової лімфоплазмоцитарними елементами, зменшенням клітин Панета в ділянці дна крипт. 46. Лікування, прогноз хронічного ентериту Лікування. Лікування хронічного ентериту має бути комплексним, що включає засоби, що впливають на етіологічні фактори, патогенетичні механізми, а також на місцеві і загальні симптоми захворювання. Базовим є дієтичне харчування, яке сприяє зниженню підвищеного осмотичного тиску в порожнині кишечника, знижує секрецію, нормалізує пасаж кишкового вмісту. Лікарська терапія має бути етіотропною, патогенетичною та симптоматичною. Етіотропне лікування: при дисбіозі II-IV ступеня призначають препарати антибактеріальної дії: метронідазол (по 0,5 г 3 рази на добу), кліндаміцин (по 0,5 г 4 рази на добу), цефалексин (по 0,5 г 2 рази на добу) добу), бісептол (по 0,48 г 2 рази на добу), сульгін (по 1 г 3-4 рази на добу), фуразолідон (0,1 г 4 рази на добу). Після застосування антибактеріальних препаратів призначають еубіотики – біфідумбактерин або біфікол по 5 доз 3 рази на добу за 30 хв до їди, колібактерин або лактобактерин по 3 дози 3 рази на добу до їди, хілак-форте по 40 крапель 3 рази на день перед їдою. Лікування бактерійними препаратами проводять тривало: 3 курси по 3 місяці протягом року. При стафілококовому дисбактеріозі призначають антистафілококовий бактеріофаг (по 20 мл 3 рази на день протягом 15-20 днів), при протейному дисбактеріозі - коліпротейний бактеріофаг внутрішньо по 20 мл 3 рази на добу, курс лікування - 2-3 тижні. Для покращення процесу травлення рекомендуються ферментні засоби: панкреатин, панзинорм форте, фестал, дигестал, панкурмен, мезим форте, трифермент, дози яких підбираються індивідуально (від 1 таблетки 3 рази на добу до 3-4 таблеток 4 рази на день) та які призначають безпосередньо до або під час їди протягом 2-3 місяців. При необхідності замісну терапію ферментами продовжують більш тривалий час. Для корекції водно-електролітних порушень показані внутрішньовенні введення панангіна 20-30 мл, глюконату кальцію 10%-ного 10-20 мл у 200-400 мл ізотонічного розчину або розчину глюкози, полііонні розчини "Дісоль", "Трисоль", "Кварта". Електролітні розчини вводять внутрішньовенно протягом 10-20 днів під контролем кислотно-основного стану та рівня електролітів крові. Прогноз та профілактика. Прогноз для життя та працездатності здебільшого сприятливий. Прогностично несприятливими ознаками є безперервно-рецидивний перебіг хвороби, різке схуднення, анемія, синдром ендокринних порушень (зниження лібідо, дисменорея, безплідність). Профілактика хронічних ентеритів полягає у своєчасному лікуванні гострих кишкових інфекцій та супутніх захворювань гастродуоденальної зони, у дотриманні режиму харчування, у профілактичному прийомі бактерійних препаратів при проведенні рентгено- та радіотерапії. 47. Етіологія, патогенез, клінічна картина хвороби Крона Хвороба Крона – хронічне захворювання кишечника із системними проявами; морфологічна основа якого становить гранулематозне аутоімунне запалення шлунково-кишкового тракту. Етіологія та патогенез. Етіологія та патогенез захворювання вивчені недостатньо. Найбільш популярними вважаються інфекційна та імунна концепції виникнення хвороби. В останні роки з'явилися повідомлення про етіологічну роль мікроорганізмів роду єрсиній. Однак важко встановити, чи ці мікробні агенти є збудниками або комменсалами. Водночас у патогенезі захворювання важлива роль належить змінам у кишковій мікрофлорі. Типово зменшення бактерій типу біфідум при одночасному збільшенні ентеробактерій, що мають ознаки патогенності. У розвитку захворювання мають значення аутоімунні механізми. При хворобі Крона з'являються аутоантитіла (lgС, lgМ) проти тканин кишківника. Класифікація. Класифікація (Ф. І. Комаров, А. І. Казанов, 1992). 1. Течія: гостра; хронічний. 2. Характеристика процесу: ураження у межах тонкої кишки; поразка в межах ілеоцекальної області; ураження в межах товстої кишки. 3. Ускладнення: звуження кишки; токсична дилатація товстої кишки; нориці; амілоїдоз; нефролітіаз, холелітіаз; В12-дефіцитна анемія. Клінічна картина. Клінічна картина хвороби Крона характеризується значною різноманітністю, яка визначається локалізацією та протяжністю патологічного процесу в кишечнику, формою захворювання та приєднанням ускладнень. При об'єктивному дослідженні звертають увагу на блідість шкірних покривів, що корелює з вираженістю анемії, набряки на ногах внаслідок порушення всмоктування та обміну білка. При пальпації живота відзначаються метеоризм, бурчання. При фізикальному обстеженні хворого визначаються блідість шкіри, субфебрилітет, дефіцит маси тіла, при пальпації виявляють спазмовані петлі кишечника, болючість у параумбілікальній зоні, у правій здухвинній ділянці. При хворобі Крона відзначаються позакишкові ознаки захворювання: афтозний стоматит, флегмони та нориці ротової порожнини, артрит, що нагадує по клініці ревматоїдний, з характерними симптомами симетричного ураження дрібних суглобів, скутістю вранці. Типові зміни з боку очей: ірит, іридоцикліт, макулопатія. На шкірі можлива поява вузлової еритеми та гангренозної піодермії. Діарея характеризується збільшенням частоти випорожнень до 10 разів на добу і більше, поліфекалією. Обсяг випорожнень визначається анатомічною локалізацією процесу. Втрата маси тіла спостерігається у всіх хворих. 48. Діагностика хвороби Крона Діагностика та диференціальний діагноз. У клінічному аналізі крові у період загострення виявляють лейкоцитоз, анемію, підвищення ШОЕ. Зміни у загальному аналізі сечі з'являються при тяжкій формі, що характеризується приєднанням амілоїдозу нирок (протеїнурія). При біохімічному дослідженні крові виявляються гіпопротеїнемія, гіпоальбумінемія, збільшення a-глобулінів, зниження вмісту заліза, вітаміну В12, фолієвої кислоти, цинку, магнію та калію. Дані копрологічного дослідження дозволяють опосередковано оцінити рівень поразки. У копрограмі при тонкокишковій локалізації процесу виявляють поліфекалію, стеаторею, креаторею; при товстокишковій – домішка слизу, лейкоцити, еритроцити. Рентгенологічна діагностика дозволяє встановити локалізацію та поширеність патологічного процесу в кишечнику. Ділянки ураженого кишечника чергуються з ділянками незміненої кишки. Змінені петлі стають ригідними, мозаїчна картина з дрібними дефектами наповнення і з проникненням контрасту за межі кишкової стінки у вигляді кишень. Кишка в зоні ураження набуває характеру дрібнобахромчастої, з формуванням псевдодивертикулів. Контрактильна здатність кишкової стінки знижується або повністю втрачається, евакуація барію сповільнюється. Спостерігається нерівномірне звуження просвіту кишки, в результаті він стає настільки вузьким, що набуває вигляду шнурка. Над зоною звуження кишка розширюється. Ендоскопічна діагностика набуває вирішального значення у верифікації діагнозу. Для хвороби Крона найбільш характерна зміна антрального відділу шлунка та початкового відділу дванадцятипалої кишки. Ендоскопічно можливе виявлення циркулярного звуження антрального відділу, що нагадує пухлинний стеноз. Початковий період хвороби Крона характеризується мізерними ендоскопічними даними: тьмяна слизова оболонка, на тлі якої видно ерозії на кшталт афт, оточені білуватими грануляціями. Судинний малюнок відсутній або згладжений. У просвіті кишки та її стінках визначається гноевидная слиз. При клінічній ремісії ці зміни можуть повністю зникати. У міру прогресування захворювання слизова оболонка стає нерівномірно потовщеною, має білуватий колір, відзначаються великі поверхневі або глибокі виразки-тріщини. Просвіт кишки звужується, ускладнюючи поступ колоноскопа. Колоноскопія дає можливість виконати прицільну біопсію слизової оболонки на будь-якій ділянці товстої кишки та в термінальному відділі клубової. При хворобі Крона патологічний процес починається в підслизовому шарі, тому біопсія повинна проводитися так, щоб у біопсійний матеріал потрапила ділянка підслизового шару. У зв'язку з викладеним у 54% випадків морфологічний субстрат хвороби не виявляється. 49. Лікування хвороби Крона Лікування. Призначають механічно та хімічно щадну дієту з підвищеним вмістом білків, вітамінів, мікроелементів, за винятком молока при його непереносимості, обмеженням грубої рослинної клітковини. Показано застосування рідких ентеральних гідролізатів. Основу патогенетичної медикаментозної терапії складають салазопрепарати та кортикостероїди. Добова доза препаратів – 3-6 г. При локалізації патологічного процесу у товстій кишці активність сульфасалазину перевищує активність преднізолону. За відсутності ефекту від застосування сульфасалазину, при ураженні переважно тонкої кишки та виражених ознак імунного запалення, а також за наявності системних проявів захворювання показано застосування кортикостероїдів. Ефект від їх застосування відзначається у перші 8 тижнів від початку лікування. Преднізолон призначають за наступною схемою: у розпал загострення 60 мг на добу, потім дозу поступово знижують і до 6-10-го тижня доводять до підтримуючої – 5-10 мг на добу. При досягненні клінічної ремісії препарат поступово скасовують. Якщо ремісії не досягнуто, лікування преднізолоном триває амбулаторно до 52 тижнів. При тяжкому перебігу захворювання у разі розвитку ускладнень у вигляді торпідно поточних ректовагінальних, шкірно-ентеральних, ентеро-ентеральних нориць показано призначення 6-меркаптопурину всередину по 0,05 г 2-3 рази на день 10-денними курсами з інтервалом у 3 дні до досягнення клінічної ремісії. Надалі переходять приймання підтримують доз препарату протягом року. Доза 6-меркаптопурину становить 75 мг на добу. Ефект лікування імунодепресантами можна визначити не раніше ніж через 3-4 місяці. Широке застосування в лікуванні хвороби Крона знайшов метронідазол, основними показаннями до призначення якого є періанальні нориці та тріщини, відсутність ефекту від салазопрепаратів та глюкокортикоїдів, а також рецидиви захворювання після проктектомії. Препарат призначають у дозі 500-1000 мг на добу. Тривалість безперервного курсу має перевищувати 4 тижнів. Симптоматична терапія хвороби Крона зводиться до призначення коротких курсів (по 2-3 дні) антидіарейних препаратів (імодіуму, лопераміду). Дози підбираються індивідуально за клінічним ефектом. Не слід призначати антидіарейні засоби тривалий час (більше 5 днів). У зв'язку з наявністю при хворобі Крона синдрому мальабсорбції використовують ферментні препарати, які не містять жовчних кислот (панкреатин, мезим-форте, солізим, сомілаза) у дозі від 2 до 6 таблеток з кожним прийомом їжі. За показаннями проводиться корекція анемії та гіпоальбумінемії призначенням препаратів заліза (парентерально) та введенням альвезину, гідролізаторів білків, амінопептиду, амінокровину. Призначають полівітаміни у дражі, есенціалі у капсулах. Лікування дисбактеріозу проводять за загальними правилами. 50. Класифікація неспецифічного виразкового коліту Неспецифічний виразковий коліт - запальне захворювання, що вражає слизову оболонку товстої кишки з виразково-деструктивними змінами, що має хронічний рецидивний перебіг, що нерідко супроводжується розвитком небезпечних для життя ускладнень. Класифікація (Ю. В. Балтайтіс із співавт., 1986). Клінічна характеристика. 1. Клінічна форма: 1) гостра; 2) хронічна. 2. Течія: 1) швидко прогресуюче; 2) безперервно рецидивуючий; 3) рецидивуючий; 4) латентне. 3. Ступінь активності: 1) загострення; 2) загасне загострення; 3) ремісія. 4. Ступінь тяжкості: 1) легка; 2) середньої тяжкості; 3) важка. анатомічна характеристика. 1. Макроскопічна характеристика: 1) проктит: 2) проктосигмоїдит; 3) субтотальне ураження; 4) тотальна поразка. 2. Мікроскопічна характеристика: 1) переважання деструктивно-запальних процесів; 2) зменшення запальних процесів із елементами репарації; 3) наслідки запального процесу Ускладнення. 1. Місцеві: 1) кишкова кровотеча; 2) перфорація товстої кишки; 3) звуження товстої кишки; 4) псевдополіпоз; 5) вторинна кишкова інфекція; 6) зникнення слизової оболонки; 7) токсична дилатація товстої кишки; 8) малігнізація. 2. Загальні: 1) функціональний гіпокортицизм; 2) сепсис; 3) системні прояви – артрити, сакроілеїти, ураження шкіри, ірити, амілоїдоз, флебіти, склерозуючий холангіт, дистрофія печінки. 51. Клінічна картина виразкового коліту Клінічна картина. Клініка виразкового коліту поліморфна і залежить від гостроти перебігу та тяжкості процесу. Перебіг запального процесу, що розглядається частіше як хронічний, у ряді випадків набуває гострого характеру. Протяжність ураження товстої кишки може змінюватися. Для неспецифічного виразкового коліту характерні 3 провідні симптоми: виділення червоної крові при дефекації, порушення функцій кишечника та біль у животі. Порушення функцій кишечника проявляється у вигляді скарг на багаторазовий нестійкий стілець, який стає наслідком великого ураження слизової оболонки та зниження всмоктування води та солей. Найчастіше діарея спостерігається при тяжкій формі неспецифічного виразкового коліту. Однак діарея не є надійним критерієм тяжкості процесу. Має значення вираженість діареї у поєднанні з наявністю яскраво-червоної крові в калі. У значної кількості хворих з неспецифічним виразковим колітом кров і слиз періодично виявляються лежить на поверхні оформленого калу, що часто помилково розцінюється як прояв геморою. Легкий перебіг неспецифічного виразкового коліту характеризується задовільним станом пацієнтів. Болі в животі помірні та короткочасні. Стілець оформлений, прискорений, до 2-3 разів на добу. У калі виявляються кров та слиз. Процес локалізований у межах прямої та сигмовидної кишок. Клінічний перебіг рецидивуючий. Ефект лікування салазопрепаратами задовільний. Рецидиви спостерігаються не частіше 2 разів на рік. Ремісії можуть бути тривалими (понад 2-3 роки). Середньотяжкий перебіг захворювання діагностують за наявності у хворого на діарею. Стілець частий (до 6-8 разів на добу), у кожній порції видно домішку крові та слизу. Переймоподібні болі в животі мають більшу інтенсивність. Спостерігаються лихоманка, що інтермітує, з підйомом температури тіла до 38 C, інтенсивна загальна слабкість. Можуть відзначатись і позакишкові прояви захворювання (артрит, увеїт, вузлова еритема). Течія безперервно-рецидивна, ефект від салазопрепаратів нестійкий, у період загострень призначають гормони. Для важкої форми захворювання характерний гострий початок. Швидко розвивається тотальне ураження товстої кишки з поширенням патологічного процесу вглиб кишкової стінки. Стан хворого різко погіршується. Клініка характеризується раптовим початком, високою лихоманкою, профузними проносами до 24 разів на добу, кишковою кровотечею, швидким наростанням зневоднення. З'являється тахікардія, знижується артеріальний тиск, наростають позакишкові прояви неспецифічного виразкового коліту. Консервативне лікування не завжди ефективне, нерідко потрібне екстрене хірургічне втручання. 52. Діагностика неспецифічного виразкового коліту Діагностика та диференціальний діагноз. У клінічних аналізах крові за легкої форми захворювання відзначаються незначний нейтрофільний лейкоцитоз, збільшення ШОЕ, показники червоної крові не змінені. У міру наростання тяжкості перебігу та збільшення тривалості загострення виникають анемії змішаного генезу (В12-дефіцитна та залізодефіцитна), підвищується ШОЕ. У біохімічному аналізі крові при середньотяжкій та тяжкій формах відзначаються диспротеїнемія, гіпо-альбумінемія, гіпергаммаглобулінемія, порушення електролітного балансу, кислотно-лужного стану. У загальному аналізі сечі зміни з'являються лише при виникненні ускладнень у вигляді нефротичного синдрому на тлі амілоїдозу, коли відзначаються характерні зміни в аналізах сечі – протеїнурія, “мертвий” сечовий осад, відзначається також підвищення у крові та рівня креатиніну, сечовини. Головну роль у діагностиці набуває ендоскопічне дослідження з прицільною біопсією, оскільки при неспецифічному виразковому коліті уражається насамперед слизова оболонка товстої кишки. У патологічний процес завжди залучається пряма кишка, т. е. ерозивно-виразкові зміни виявляються при ендоскопії відразу ж за анальним сфінктером при ректороманоскопії. При виразковому коліті ректосигмоїдний вигин подолати який завжди можливо через вираженого спазму. Спроба провести тубус ректоскопа супроводжується вираженими болючими відчуттями. У цій ситуації ректоскоп слід вводити на глибину трохи більше 12-15 див. Ендоскопічна картина залежить від форми захворювання. При легкій формі видно набрякла тьмяна слизова оболонка, густі білуваті накладення слизу на стінках кишки, незначна контактна кровоточивість. Судинний малюнок підслизового шару візуально не визначається. При середньотяжкому перебігу захворювання виявляються гіперемія та набряк слизової оболонки, виражена контактна кровоточивість, геморагії, ерозії та виразки неправильної форми, густі накладення слизу на стінках кишки. При тяжкому перебігу захворювання слизова оболонка товстої кишки руйнується значному протязі. Виявляються зерниста, внутрішня поверхня, що кровоточить, великі зони виразок з фібринозними накладаннями, псевдополіпи різної величини і форми, гній і кров у просвіті кишки. Протипоказанням до проведення колоноскопії та сигмоскопії є важкі форми неспецифічного виразкового коліту у гострій стадії хвороби. За наявності епідемії кишкових інфекцій діагноз встановлюється легко. Але навіть у разі спорадичної захворюваності при гострих кишкових інфекціях колітичний синдром тече без рецидивів, тоді як неспецифічний виразковий коліт має рецидивний перебіг. До найточніших методів ідентифікації гострої кишкової інфекції відносять бактеріологічний та серологічний. 53. Лікування неспецифічного виразкового коліту Лікування. Відсутність єдиного етіологічного фактора та складність патогенезу неспецифічного виразкового коліту ускладнюють лікування цього захворювання. Застосовують препарати, що мають протизапальну та антибактеріальну дію: салазопіридазин, сульфасалазин, салазодиметоксин, салофальк. Прийнятий внутрішньо сульфасалазин за участю кишкової мікрофлори розпадається на 5-аміносаліцілову кислоту і сульфапіридин. Неабсорбований сульфапіридин пригнічує в кишечнику зростання анаеробної мікрофлори, у тому числі клостридій та бактеріодів. А завдяки 5-аміно-саліциловій кислоті препарат не тільки викликає зміни у кишковій мікрофлорі, а й модулює імунні реакції, блокує медіатори запального процесу. Призначають препарат у дозі 2-6 г на добу протягом усього періоду активного запалення. При стиханні колітичного синдрому дозу сульфасалазину зменшують поступово, доводячи до підтримуючої (в середньому по 1-1,5 таблетки на день). При вираженому діарейному синдромі в осіб з легким та середньотяжким перебігом захворювання показано призначення сандостатину, який інгібує синтез гастроінтестинальних гормонів та біогенних амінів (вазоактивного інтестинального пептиду, гастрину, серотоніну), продукція яких різко підвищена при виразковому коліті та хворобі. А також препарат зменшує секрецію та покращує всмоктування у кишечнику, пригнічує вісцеральний кровотік та знижує моторику. При застосуванні сандостатину (протягом 7 днів у дозі 0,1 мг 2 рази підшкірно) зменшується діарея, практично зникають тенезми, знижується виділення крові з калом. При тяжкій формі неспецифічного виразкового коліту лікування проводиться на тлі парентерального харчування. Вміст білка у цих препаратах має становити приблизно 1,5-2,0 г/кг маси тіла. Патогенетичним засобом терапії при тяжкій формі хвороби є кортикостероїди, які вводяться парентерально: протягом першої доби преднізолон вводять внутрішньовенно з інтервалом 12 год (90-120 і більше мг), у наступні 5 діб – внутрішньом'язово, поступово знижуючи дозу. При позитивному ефекті переходять на пероральний прийом препаратів (Преднізолон 40 мг на добу). При середньотяжкій формі перебігу неспецифічного виразкового необхідна строга дієта з обмеженням клітковини, молочних продуктів та підвищеним вмістом білка. Преднізолон призначають внутрішньо у початковій дозі 20-40 мг на добу. До лікування можна додавати сульфасалазин та його аналоги, які приймають внутрішньо або вводять у мікроклізмах та свічках у пряму кишку. Початкова доза сульфасалазину – 1 г на добу, потім її збільшують до 4-6 г. Як допоміжний метод лікування можуть бути застосовані відвари трав, що мають протизапальну та гемостатичну дію (корінь кровохлібки, лист кропиви, лишайник, шишки сірої вільхи, корінь солодки), фітотерапія нерідко дозволяє зменшити дозу салазопрепаратів, продовжити ремісію. 54. Клінічна картина гострого громерулонефриту Гострий гломерулонефрит (ОГН) – гостре дифузне захворювання нирок інфекційно-алергічної природи, що локалізується у клубочках. ОГН може бути самостійним захворюванням (первинний) або мати вторинний характер у складі іншого захворювання, ускладнюючи клінічну картину та діагностику останнього. ОГН хворіють, як правило, чоловіки молодого та середнього віку. Клінічна картина. Клінічна картина захворювання складається із наступних синдромів. Сечовий синдром. 1. Протеїнурія внаслідок проходження молекул білка через простору стінки капіляра клубочка, що утворився під час осадження ними імунних комплексів. Протеїнурія носить селективний характер, коли через гломерулярний "фільтр" проходять переважно альбуміни. 2. Гематурія внаслідок залучення до патологічного процесу мезангії капілярів та інтерстиціальної тканини. Еритроцити проникають через найдрібніші розриви базальної мембрани, змінюючи свою форму. 3. Циліндрурія - виділення із сечею циліндричних клітин канальців. При дистрофічних процесах в канальцях з клітин клітин ниркового епітелію, що розпалися, утворюються зернисті циліндри, що складаються з щільної зернистої маси; воскоподібні циліндри мають різкі контури та гомогенну структуру; гіалінові циліндри є білковими утвореннями. Гіпертонічний синдром спостерігається внаслідок: 1) затримки натрію та води; 2) активації ренін-ангіотензин-альдостеронової та симпатоадреналової систем; 3) зниження функції депресорної системи нирок. Набряковий синдром пов'язують із наступними факторами: 1) зниженням клубочкової фільтрації внаслідок їх ураження; 2) зменшенням фільтраційного заряду натрію та підвищенням його реабсорбції; 3) затримкою води внаслідок затримки в організмі натрію; 4) збільшенням ОЦК; 5) вторинним гіперальдостеронізмом; 6) підвищенням секреції АДГ та збільшенням чутливості дистальних відділу нефрону до нього, що призводить до затримки рідини; 7) підвищенням проникності стінок капілярів та виходом плазми в тканині; 8) зниженням онкотичного тиску плазми при масивній протеїнурії. 55. Діагностика гострого громерулонефриту Діагностика У 100% випадків при дослідженні сечі діагностуються протеїнурія різного ступеня вираженості, циліндрурія і, що має найбільше значення для діагностики, гематурія різного ступеня виразності - від мікрогематурії (до 10 еритроцитів у полі зору) до макрогематурії (хоч і досить рідкісної). Однак при підозрі на ОДН необхідно провести серію повторних досліджень сечі або поставити пробу Нечипоренка (визначення кількості формених елементів 1 мкл), оскільки в одноразовій порції сечі еритроцитів можна не виявити. При дослідженні крові виявляються острофазові показники (підвищення вмісту фібриногену та a2-глобуліну, С-реактивного білка, прискорення ШОЕ), кількість лейкоцитів змінюється мало, помірна анемія. При неускладненому перебігу ОГН вміст у крові азотистих речовин (креатиніну, індикану, сечовини) не змінюється. У початковій фазі хвороби спостерігається зміна проби Реберга - зниження клубочкової фільтрації та підвищення канальцевої реабсорбції, що нормалізується в міру одужання. При рентгенологічному дослідженні у хворих з вираженою артеріальною гіпертензією може спостерігатися помірне збільшення лівого шлуночка, який приймає колишні розміри в міру одужання хворого. Виділяють 3 клінічні варіанти ОПН. 1. Моносимптомний варіант: незначні скарги, відсутність набряків та артеріальної гіпертензії, є лише сечовий синдром; найчастіший варіант перебігу захворювання (86% випадків). 2. Нефротичний варіант: виражені набряки, олігурія, можливе підвищення артеріального тиску до відносно невисоких цифр, виявляється у 8% хворих. 3. Розгорнутий варіант: артеріальна гіпертензія, що досягає високих цифр (180/100 мм рт. ст.), помірно набряки, недостатність кровообігу, зустрічається в 6% випадків. 56. Лікування гострого громерулонефриту Лікування. Лікування при ОДН комплексне і включає наступні заходи. 1. Режим. При підозрі на ОДН або відразу після встановлення діагнозу хворий має бути негайно госпіталізований. Суворий постільний режим необхідно дотримуватись близько 2-4 тижнів до ліквідації набряків та нормалізації артеріального тиску. Перебування в ліжку забезпечує рівномірне зігрівання тіла, що веде до зменшення спазму судин (отже, до зниження артеріального тиску) та до збільшення клубочкової фільтрації та діурезу. Після виписки зі стаціонару показано домашнє лікування до 4 місяців з дня початку захворювання, що є найкращою профілактикою переходу ОПН у хронічну стадію. 2. Дієта. Залежно від вираженості клінічної симптоматики дуже важливим є обмеження рідини та кухонної солі. При розгорнутій та нефротичній формі рекомендують протягом 1-2 днів повний голод із споживанням рідини у кількості, що дорівнює діурезу. На 2-3 день показано споживання їжі, багатої солями калію (рисової каші, картоплі). Загальна кількість випитої води на добу має дорівнювати обсягу виділеної за попередню добу сечі плюс 300-500 мл. Через 3-4 дні хворого переводять на дієту з обмеженням білка (до 60 г на добу), а загальна кількість солі – не більше 3-5 г на добу. Такої дієти рекомендується дотримуватися до зникнення всіх позаниркових симптомів та різкого поліпшення сечового осаду. 3. Лікарська терапія включає насамперед антибактеріальну терапію, яку, проте, слід проводити лише у разі достовірності встановлення інфекційної природи ОГН (збудник виділено і з початку захворювання пройшло трохи більше 3 тижнів). Зазвичай призначають пеніцилін або його напівсинтетичні аналоги у загальноприйнятих дозах. Наявність явних вогнищ хронічної інфекції (тонзиліту, гаймориту тощо) також є прямим показанням до проведення антибактеріальної терапії. Сечогінні засоби в терапії ОПН показані лише при затримці рідини, підвищенні артеріального тиску та появі серцевої недостатності. Найбільш ефективний фуросемід (40-80 мг), що застосовується до ліквідації набряків та артеріальної гіпертензії. Немає потреби у тривалому призначенні даних препаратів, достатньо 3-4 прийомів. За відсутності набряків, але гіпертензії, що зберігається, або при недостатньому антигіпертензивному ефекті салуретиків призначають гіпотензивні препарати (клофелін, допегіт) з тривалістю прийому, що залежить від стійкості артеріальної гіпертензії. При протеїнурії, що затягнулася, призначають індометацин або вольтарен по 75-150 мг на добу (при відсутності гіпертензії та олігурії). Прогноз сприятливий, проте при формах, що затягнулися, є ймовірність переходу процесу в хронічний. Профілактика ОПН зводиться до ефективного лікування осередкової інфекції, раціонального загартовування. З метою своєчасного виявлення початку хвороби після вакцинації, перенесених на ГРВІ у всіх хворих необхідно обов'язково дослідити сечу.
▪ Медична статистика. Шпаргалка ▪ Безпека життєдіяльності. Шпаргалка ▪ Цивільне право. Особлива частина. Шпаргалка
Новий спосіб управління та маніпулювання оптичними сигналами
05.05.2024 Приміальна клавіатура Seneca
05.05.2024 Запрацювала найвища у світі астрономічна обсерваторія
04.05.2024
▪ Два сімейства недорогих високошвидкісних контролерів USB 18.03.2005 ▪ Глобальне потепління спровокує рекордну кількість переселенців ▪ Суперклей для зламаних кісток ▪ Водостійка клавіатура від Logitech ▪ Безпілотник попередить про цунамі
▪ розділ сайту Охорона праці. Добірка статей ▪ стаття Відповідність моделей та шасі телевізорів. Довідник ▪ стаття Де найбільш стрімкий берег? Детальна відповідь ▪ стаття Антуріум. Легенди, вирощування, способи застосування ▪ стаття Інструмент електрика. Енциклопедія радіоелектроніки та електротехніки ▪ стаття Мікросхеми. Стабілізатор напруги 1158ЕНхх. Енциклопедія радіоелектроніки та електротехніки
Головна сторінка | Бібліотека | Статті | Карта сайту | Відгуки про сайт www.diagram.com.ua |






 Arabic
Arabic Bengali
Bengali Chinese
Chinese English
English French
French German
German Hebrew
Hebrew Hindi
Hindi Italian
Italian Japanese
Japanese Korean
Korean Malay
Malay Polish
Polish Portuguese
Portuguese Spanish
Spanish Turkish
Turkish Ukrainian
Ukrainian Vietnamese
Vietnamese





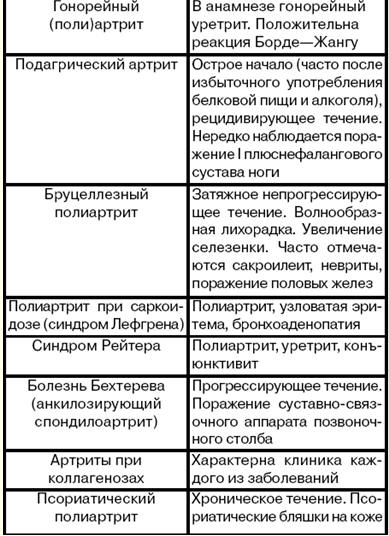
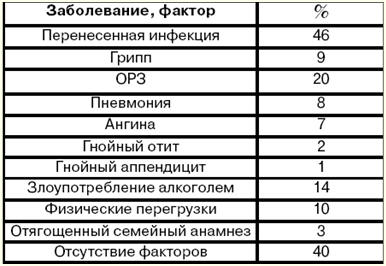
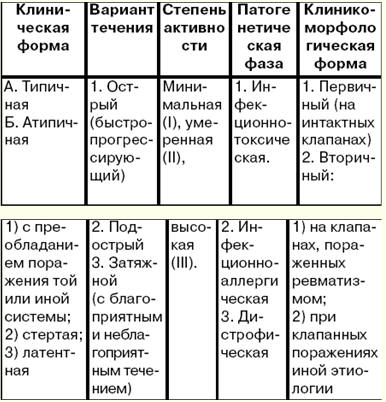
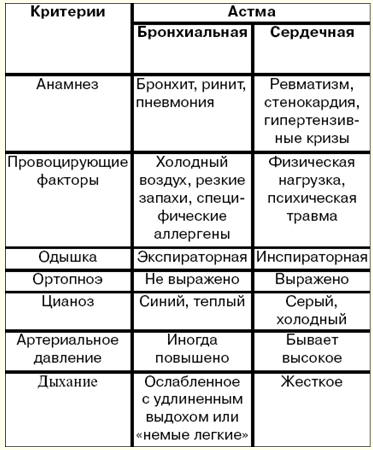

 Дивіться інші статті розділу
Дивіться інші статті розділу 